ВАРИАНТЫ КОНТРОЛЬНЫХ РАБОТ
ТЕМА: "Основные законы
термодинамики"
Вариант 1-К1-98
- Найдите энтальпию и внутреннюю энергию реакции
восстановления муравьиной кислоты при 298 К:
НСООН (ж) + 3Н2 = СН4 + 2Н2О (ж),
если известно, что энтальпии сгорания
газообразной муравьиной
кислоты, водорода и метана, соответственно, равны:
-71.77; -68.315; - 12.80 ккал/моль, а энтальпия
испарения муравьиной кислоты при 298 К равна 241
кал/г. (7 баллов)
- Вычислите изменение энтропии в процессе
перехода 2 молей воды в лед, если вода
переохлаждена до -5 0С и процесс
протекает неравновесно при этой температуре;
давление постоянно и равно 1 атм. Энтальпия
плавления льда при 0 0С равна 6008 Дж/моль, СР
льда и жидкой воды составляют, соответственно,
37.66 и 76.00 Дж/моль.К. (9 баллов)
- Для реакции 0.5N2 + 0.5O2 = NO,
протекающей в газовой фазе при 298 К,
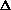 F0 (298 К) = 20.66 ккал/моль.
Найдите изменения внутренней энергии, энтальпии,
энтропии, энергии Гельмгольца и энергии Гиббса
для данной реакции при 473 К, если S0 (298 К)
равны, соответственно, 45.70 э.е. (N2), 49.06 э.е. (О2), 50.34 э.е.(NO), а СР составляют,
соответственно, 7.05 кал/моль.К (N2), 6.97 кал/моль.К (О2) и
7.14 кал/моль.К (NO). (9 баллов)
F0 (298 К) = 20.66 ккал/моль.
Найдите изменения внутренней энергии, энтальпии,
энтропии, энергии Гельмгольца и энергии Гиббса
для данной реакции при 473 К, если S0 (298 К)
равны, соответственно, 45.70 э.е. (N2), 49.06 э.е. (О2), 50.34 э.е.(NO), а СР составляют,
соответственно, 7.05 кал/моль.К (N2), 6.97 кал/моль.К (О2) и
7.14 кал/моль.К (NO). (9 баллов)
Вариант 2-К1-98
Рассчитайте изменение энергии Гиббса при
одновременном нагревании и расширении 4 г CO2
от 1 л при 25 0С до 10 л при 125 0С.
CР (CO2) = 37 Дж/моль.К,
энтропия газа в начальном состоянии 210 Дж/моль.К.
(10 баллов)
Исходя из определения энергии Гиббса, первого и
второго законов термодинамики, найдите
выражение для дифференциала dG. Запишите
соответствующее уравнение Максвелла. (5 баллов)
Вычислите энтальпию образования и внутреннюю
энергию образования гидразина при 25 0С
из следующих данных:
2NH3 + 3N2O = 4N2 + 3H2O (ж)
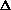 rH0
= -1010 кДж/моль
rH0
= -1010 кДж/моль
N2O + 3H2 = N2H4 (ж)+ H2O (ж)
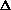 rH0
= -387 кДж/моль
rH0
= -387 кДж/моль
2NH3 + 0.5O2 = N2H4 (ж)+ H2O (ж)
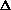 rH0
= -143 кДж/моль
rH0
= -143 кДж/моль
H2 + 0.5O2 = H2O (ж) 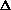 rH0
= -286 кДж/моль
rH0
= -286 кДж/моль
(10 баллов)
Вариант 3-К1-98
В цилиндре диаметром 40 см содержится 80 л
воздуха при температуре 15 0С и давлении
3 атм. Принимая теплоемкость воздуха СР
равной 6.5 кал/моль.К, определить, какую
величину должна иметь сила, действующая на
поршень, которым снабжен цилиндр, чтобы поршень
оставался неподвижным, если к воздуху подводится
20 ккал тепла. (10 баллов)
Определить 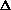 G,
G, 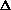 F и
F и 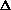 S при испарении 1 моля воды при
100 0С и 1 атм, если удельный объем воды
равен 1.044 см3/г, удельный объем
пара - 1.673.104 см3/г, а
изменение энтальпии в процессе парообразования
равно 2271.5 Дж/г. (9 баллов)
Для идеального газа найдено: (
S при испарении 1 моля воды при
100 0С и 1 атм, если удельный объем воды
равен 1.044 см3/г, удельный объем
пара - 1.673.104 см3/г, а
изменение энтальпии в процессе парообразования
равно 2271.5 Дж/г. (9 баллов)
Для идеального газа найдено: (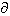 H/
H/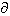 P)x(
P)x( 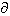 U/
U/ 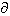 V)y = - RT .Что
подразумевается под x и y? (6 баллов)
V)y = - RT .Что
подразумевается под x и y? (6 баллов)
ТЕМА: "Химические и фазовые
равновесия. Растворы"
Вариант 1-К2-98
Найдите состав равновесной смеси в реакции
СО + Н2О = СО2 + Н2,
протекающей в газовой фазе при 1089 К , если в
начале реакции в системе было 2 моля СО, 3 моля Н2О
и 1моль Н2. Константа равновесия КР = 1.
(7 баллов)
Для 1,4 - диоксана зависимость давления пара
от температуры над твердой фазой может быть
выражена в виде
lgР (мм рт. ст.) = - 2302.6/T + 9.4653, а
над жидкой фазой в виде
lgР (мм рт. ст.) = - 1297.1/Т + 5.9712
(Т, К). Найдите координаты тройной точки
(Т и Р), изменения энтальпии, энтропии и
энергии Гиббса плавления в ней. (10 баллов)
Найдите средний коэффициент активности 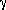
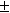 НСl, если ЭДС цепи: Pt(H2)|
HCl(р-р)|AgCl|Ag|Pt при 20oС
и концентрации водного раствора
HCl 1.021 моль/кг равна 0.236 В, а Еo= 0.226В.
(8 баллов)
НСl, если ЭДС цепи: Pt(H2)|
HCl(р-р)|AgCl|Ag|Pt при 20oС
и концентрации водного раствора
HCl 1.021 моль/кг равна 0.236 В, а Еo= 0.226В.
(8 баллов)
Вариант 2-К2-98
Газовая смесь, содержащая 97 мольных % Н2О
и 3 мольных % Н2, нагрета до 1000 К.
Будет ли эта смесь реагировать с Ni, образуя NiO,
если для реакции Ni (тв) + 0.5О2 = NiO (тв)
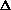 rG0 (1000 К) = - 35400 кал/моль,
а степень диссоциации водяного пара по уравнению
Н2О = Н2 + 0.5О2 при
1000 К и давлении 1 атм равна 2.467.10-7?
Все газы считать идеальными. (11 баллов)
Давление диссоциации LiCl.NH3 (тв)
при 96 0С равно 489 гПа, а при 109.2 0С равно 861 гПа.
Рассчитать средний тепловой эффект реакции LiCl.NH3 (тв) = LiCl (тв)+ NH3 (г),
приняв, что
rG0 (1000 К) = - 35400 кал/моль,
а степень диссоциации водяного пара по уравнению
Н2О = Н2 + 0.5О2 при
1000 К и давлении 1 атм равна 2.467.10-7?
Все газы считать идеальными. (11 баллов)
Давление диссоциации LiCl.NH3 (тв)
при 96 0С равно 489 гПа, а при 109.2 0С равно 861 гПа.
Рассчитать средний тепловой эффект реакции LiCl.NH3 (тв) = LiCl (тв)+ NH3 (г),
приняв, что 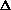 СР = 0. (7 баллов)
Энтропия жидкого о-ксилола при 25 0С S0 (ж) = 58.8 кал/моль.К,
давление его насыщенного пара в интервале
температур 0-60 0С дается уравнением
lgР (мм рт. ст.) = - 3327.16/Т - 8.0.lgТ + 31.7771 (Т, К).
Вычислить равновесное давление пара о-ксилола
при 25 0С и стандартное значение энтропии
парообразного о-ксилола при 25 0С.
(7 баллов)
СР = 0. (7 баллов)
Энтропия жидкого о-ксилола при 25 0С S0 (ж) = 58.8 кал/моль.К,
давление его насыщенного пара в интервале
температур 0-60 0С дается уравнением
lgР (мм рт. ст.) = - 3327.16/Т - 8.0.lgТ + 31.7771 (Т, К).
Вычислить равновесное давление пара о-ксилола
при 25 0С и стандартное значение энтропии
парообразного о-ксилола при 25 0С.
(7 баллов)
Вариант 3-К2-98
Давление насыщенного пара бензола при 6 0С
равно 36 мм. рт. ст. Чему равно давление
насыщенного пара при 25 0С, если энтальпия
испарения равна 31 кДж/моль. Перечислите все
условия, при которых будет справедливо решение
задачи. (6 баллов)
Температура замерзания чистой уксусной кислоты
равна 16.60 0С, а температура замерзания
раствора, полученного растворением 0.4 г
неизвестного углеводорода в 25 г уксусной
кислоты, понижается до 16.15 0С. Оценить
молярную массу растворенного углеводорода, если
теплота плавления уксусной кислоты равна
11.6 кДж/моль. Какое приближение необходимо
сделать, чтобы решение задачи стало возможным? (7
баллов)
На основании приведенных ниже данных
рассчитать константу равновесия реакции PCl5 (г) = PCl3 (г) + Cl2 (г)
при 300 0С. Будет ли константа равновесия
зависеть от общего давления? Будет ли степень
диссоциации пентахлорида фосфора зависеть от
общего давления? Ответ обоснуйте. (12 баллов)
|
PCl5 |
|
PCl3 |
|
Cl2 |
 fH0298 (кДж/моль) fH0298 (кДж/моль) |
-399 |
|
-306 |
|
0 |
| S0298 (Дж/моль.К) |
353 |
|
312 |
|
223 |
ТЕМА: "Кинетика"
Вариант 1-К3-98
За ходом реакции следили по изменению
концентрации вещества А при двух температурах Т1
и Т2. Найдите порядок реакции по
веществу А, константы скорости при Т1 и Т2
и энергию активации. (14 баллов)
t, мин |
0 |
10 |
15 |
20 |
25 |
30 |
СА (300 0С),моль/л |
1.000 |
0.898 |
0.855 |
0.806 |
0.769 |
0.735 |
СА (500 0С),моль/л |
1.000 |
0.746 |
0,658 |
0.592 |
0.541 |
0.490 |
Вариант 2-К3-98
Определить порядок и константу скорости
реакции разложения этиленоксида по
уравнению:
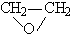 (г)
(г)  СН4 (г) + СО (г).
Реакция протекает при постоянном объеме и
температуре 687.7 К. Общее давление реакционной
смеси со временем изменяется следующим образом:
СН4 (г) + СО (г).
Реакция протекает при постоянном объеме и
температуре 687.7 К. Общее давление реакционной
смеси со временем изменяется следующим образом:
| t, мин |
0 |
4 |
7 |
9 |
12 |
14 |
16 |
18 |
| Р.10-5, Па |
0.155 |
0.1624 |
0.1678 |
0.1712 |
0.1763 |
0.1795 |
0.1827 |
0.1858 |
Чему равна константа скорости при
температуре 787.7 К, если энергия активации этой
реакции составляет 83.14 кДж/моль? (20 баллов)
Вариант 3-К3-98
Для реакции изомеризации дихлорэтилена
C2H2Cl2 (транс) = C2H2Cl2 (цис)
при постоянном объеме установлены следующие
кинетические данные:
| t, мин |
0 |
10 |
20 |
30 |
| число молей C2H2Cl2 (транс) |
1 |
0.9 |
0.81 |
0.73 |
Определить константу скорости и порядок этой
реакции. Сколько времени необходимо для
изомеризации половины количества
транс-дихлорэтилена? (12 баллов)
- Часто высказывается утверждение (эмпирическое
правило Вант-Гоффа), что при температурах,
близких к комнатным, скорость реакции
удваивается при повышении температуры на 10 0С.
Вычислите энергию активации реакции, скорость
которой при повышении температуры от 27 до 37 0С
возрастает точно в два раза. (8 баллов)
Рекомендуемая литература:
- Горшков В.И., Кузнецов И.А. Основы
физической химии. М. МГУ, 1993.
- Уильямс В., Уильямс Х. Физическая химия
для биологов. М. Мир, 1976.
- Даниэльс Ф., Олберти Р. Физическая
химия. М. Мир, 1978.
- Эткинс П. Порядок и беспорядок в
природе. М. Мир, 1987.
- Стромберг А.Г., Лельчук Х.А.,
Картушинская А.И. Сборник задач по
химической термодинамике. М. Высшая школа, 1985.
- Кудряшов И.В., Каретников Г.С. Сборник
примеров и задач по физической химии. М. Высшая
школа, 1991.
- Сборник вопросов и задач по физической
химии для самоконтроля. / Под ред.
С.Ф. Белевского. М. Высшая школа, 1979.
- Лабовиц Л., Аренс Дж. Задачи по
физической химии с решениями. М. Мир, 1972.
- Краткий справочник физико-химических
величин. / Под ред. А.А. Равделя и
А.М. Пономаревой. Л. Химия, 1983.
![]() rH0
= -1010 кДж/моль
rH0
= -1010 кДж/моль![]() rH0
= -387 кДж/моль
rH0
= -387 кДж/моль![]() rH0
= -143 кДж/моль
rH0
= -143 кДж/моль ![]() rH0
= -286 кДж/моль
rH0
= -286 кДж/моль![]() (г)
(г) ![]() СН4 (г) + СО (г).
Реакция протекает при постоянном объеме и
температуре 687.7 К. Общее давление реакционной
смеси со временем изменяется следующим образом:
СН4 (г) + СО (г).
Реакция протекает при постоянном объеме и
температуре 687.7 К. Общее давление реакционной
смеси со временем изменяется следующим образом: