|
Учебные материалы по неорганической химии
Правило фаз (однокомпонентные системы)
Вопросы и задачи
1. Установите, сколько компонентов содержится
в следующих системах:
а) раствор NaH2PO4 в воде, находящийся в
равновесии с парами воды, без учета возможности
ионизации соли в воде, б) то же самое, но с учетом
возможности полной ионизации на все возможные
ионы, и) AlCl3 в воде с учетом того, что
происходит гидролиз и осаждение Al(OH)3.
2. Кристаллы сульфата меди при нагревании в
замкнутом сосуде разлагаются и выделяют воду.
Сколько фаз и компонентов содержится в данной
системе?
3. Хлорид аммония разлагается при нагревании.
Сколько образуется фаз и компонентов при
нагревании этой соли в пустом сосуде? Сколько
будет фаз и компонентов, если перед нагреванием
соли в сосуд ввести аммиак?
4. В закрытом сосуде содержится насыщенный
раствор сульфата натрия с избытком этой соли при
температуре его кипения. Сколько фаз и
компонентов имеет данная система? Сколько
степеней свободы в данной системе, и что они
собой представляют?
5. Объясните, почему система KCl - NaCl - H2O
должна рассматриваться как трехкомпонентная,
тогда как система KCl - NaBr - H2O (т.е. раствор
хлорида калия и бромида натрия в воде) должна
считаться четырехкомпонентной.
6. Для каждой из следующих систем установите
число компонентов:
а.) NH4Cl(тв), NH4+(р-р),
Cl-(р-р), H2O(ж), H3O(р-р),
H2O(г), NH3 (г), OH-(р-р), NH4OH(р-р);
б.) NH4Cl(тв), NH3 (г), HCl(г), где
парциальное давление NH3 всегда равно
парциальному давлению HCl;
в.) NH4Cl(тв), NH3 (г), HCl(г), где
парциальное давление NH3 не обязательно
равно парциальному давлению HCl;
г.) CH3COONH4(тв), CH3COO-(р-р),
NH4+(р-р), H3O+(р-р),
NH3 (р-р), OH-(р-р), CH3COOH(р-р),
H2O(ж), H2O(г), учитывая
гидролиз;
д.) CaCl2. 6H2O(тв), Ca2+(р-р),
Cl-(р-р), H2O(ж), H2O(г).
7. Почему ошибочно применение формулы
Клаузиуса-Клапейрона к фазовому переходу
алмаз-графит?
8. Докажите, что на диаграмме давление -
температура линия равновесия (жидкость)  (пар) ( Ж - П ) в однокомпонентной
системе всегда должна иметь положительный
наклон. (пар) ( Ж - П ) в однокомпонентной
системе всегда должна иметь положительный
наклон.
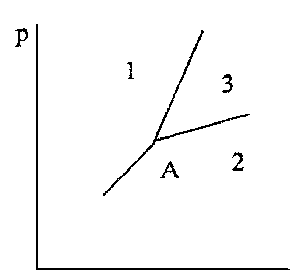
9. Согласно рисунку (на след.стр.), покажите
соотношение величин мольной энтропии s и
мольного объема v для фаз 1, 2 и 3 вблизи тройной
точки А.
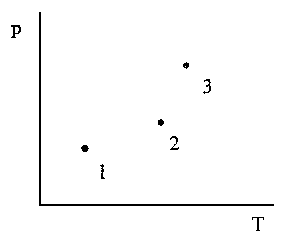
10. Простое вещество Z существует в виде пара П,
жидкости Ж, а в твердом состоянии - в трех
аллотропных модификациях 1, 2 и 3. Закончите
приведенную фазовую диаграмму и обозначьте все
линии и все поля на диаграмме. Система имеет
только три тройные точки: 1- равновесие (тв.1) (тв.2) (тв.2)  (тв.3), 2 - равновесие (тв.2)
(тв.3), 2 - равновесие (тв.2)  (тв.3) (тв.3)  П, 3 - равновесие (тв.3) П, 3 - равновесие (тв.3)  Ж Ж  П. П.
11. В процессе исследования воды при давлениях
вплоть до 3000 атм получены координаты следующих
тройных точек:
| Температура, 0С |
Давление, атм |
Фаза |
| +0.008 |
6.1. 10-3 |
Пар, жидкость, лед I |
| -22.0 |
2450 |
Лед I, лед III, жидкость |
| -34.7 |
2100 |
Лед I, лед II, лед III |
Под давлением в 1600 атм лед I и лед II находятся в
равновесии при -600С. Лед II имеет плотность
больше, чем у льда III, который плотнее жидкости
(тонет в воде).
а.) Изобразите схематическую фазовую диаграмму
воды в координатах давление-температура в
области от -60 до 00С и от 0 до 3000 атм.
Обозначьте каждую область, покажите наклон
каждой кривой.
б.) Какая фаза в каждой из перечисленных ниже
пар имеет большую энтальпию образования: лед I
или лед II, лед I или лед III, лед II или лед III?
12. Давление пара над твердым и жидким
тетрабромидом олова представлено ниже в таблице:
| |
Твердый SnBr4 |
Жидкий SnBr4 |
| t, 0C |
9.8 |
21.0 |
30.7 |
41.4 |
| р, мм рт.ст. |
0.116 |
0.321 |
0.764 |
1.493 |
Рассчитайте для SnBr4 координаты тройной
точки, энтальпию возгонки и энтальпию плавления.
Ответы:
1. а) 2, б) 2, в) 3,
- К = 2, Ф = 3,
- Ф = 2, К = 1; во втором случае рассуждения
относительно числа фаз остаются прежними, а К = 2,
4. К = 2, Ф = 3, С = 1,
6. а.) 3, б.) 1, в.) 2, г.) 4, д.) 2,
9. s2>s3>s1; v2>v3>v1,
11. б.)  fH(I) > fH(I) >  fH(II), fH(II),  fH(I)
> fH(I)
>  fH(III), fH(III),  fH(III) >
fH(III) >  fH(II) fH(II)
12. р=0.375 мм рт.ст., t=350С;  Hвозг=62.7
кДж/моль, Hвозг=62.7
кДж/моль,  Hпл=12.96 кДж/моль. Hпл=12.96 кДж/моль.
Литература
- А.Финдлей. Правило фаз и его применение. Под
ред.А.В.Раковского. М., ГОНТИ, 1932, с.11-69.
- Р.Дикерсон, Г.Грей, Дж.Хейт. Основные законы
химии: в 2-х томах. Пер. с англ.-М.: Мир, 1982, т.2, с.119-155.
- Ф.Даниэльс, Р.Олберти. Физическая химия. Пер. с
англ.-М.: Мир, 1978, с.83-143.
- П.Эткинс. Физическая химия (в 2-х тт.). М.: Мир, 1980,
т.1, с.310-344.
- Л.Лабовиц, Дж.Аренс. Задачи по физической химии с
решениями. Пер. с англ.-М.: Мир, 1972, с.87-109.
Дополнительная литература
- В.П.Древинг, Я.И.Калашников. Правило фаз с
изложением основ термодинамики. Изд.2-е, Изд-во
МГУ, 1964.
- В.Я.Аносов, М.И.Озеров, Ю.Я.Фиалков. Основы
физико-химического анализа. М.: "Наука", 1976.
|


