|
Учебные материалы по физической химии
Задачи по физической химии.Часть 1.Химическая термодинамика
11. Сумма по состояниям и ее свойства
Сумма по состояниям (синонимы - статистическая
сумма, статистический интеграл) - это нормирующий
множитель функции распределения канонического
ансамбля. Если известны уровни энергии системы Ei
и их статистические веса gi (т.е., число
уровней с энергией Ei), то сумма по
состояниям имеет вид:
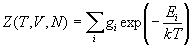 , (11.1) , (11.1)
где T - температура, V - объем системы, N
- число частиц. Название "сумма по
состояниям" отражает тот факт, что функция Z(T,V,N)
представляет собой сумму больцмановских
множителей для каждого из уровней энергии.
Иногда сумму по состояниям для системы,
состоящей из одинаковых частиц, определяют через
интеграл по фазовому пространству (отсюда
название - "статистический интеграл"). Если
известна функция Гамильтона системы H(p,q),
то сумму по состояниям определяют следующим
образом:
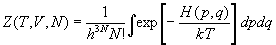 , (11.2) , (11.2)
где интеграл берется по координатам и
импульсам всех N частиц. Здесь h = 6.63 10-34 Дж. с - постоянная
Планка. Множитель перед интегралом учитывает
неразличимость частиц и квантовый принцип
неопределенности. 10-34 Дж. с - постоянная
Планка. Множитель перед интегралом учитывает
неразличимость частиц и квантовый принцип
неопределенности.
Главное достоинство суммы по состояниям
заключается в том, что она содержит в себе всю
термодинамическую информацию о системе.
Если каким-либо образом (аналитически или
численно) удалось рассчитать сумму по состояниям
системы, то можно определить все
термодинамические функции и найти уравнение
состояния этой системы. Таким образом, основная
задача статистической термодинамики сводится к
расчету сумм по состояниям термодинамических
систем.
Свойства суммы по состояниям
Все нижеперечисленные свойства вытекают из
определений (11.1) и (11.2).
1. Сумма по состояниям - безразмерная величина.
Она зависит от температуры, объема и числа
частиц: Z = Z(T,V,N). От температуры
она зависит явным образом, а от объема и числа
частиц зависят уровни энергии: Ei = Ei(V,N).
2. Сумма по состояниям - не абсолютная величина:
она определена с точностью до постоянного
множителя, который зависит от выбора точки
отсчета энергии. Если сдвинуть точку отсчета, т.е.
изменить все уровни энергии на одну и ту же
величину: Ei  Ei
+ Ei
+  , то все больцмановские
множители увеличатся (или уменьшатся) в одно и то
же число раз, и во столько же раз изменится сумма
по состояниям: , то все больцмановские
множители увеличатся (или уменьшатся) в одно и то
же число раз, и во столько же раз изменится сумма
по состояниям:
Z  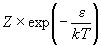
Обычно за точку отсчета принимают энергию
системы при абсолютном нуле, U0.
3. При T  0 все больцмановские
множители стремятся к 0 за исключением того,
который соответствует нижнему уровню энергии,
поэтому сумма по состояниям стремится к
статистическому весу этого уровня: 0 все больцмановские
множители стремятся к 0 за исключением того,
который соответствует нижнему уровню энергии,
поэтому сумма по состояниям стремится к
статистическому весу этого уровня:
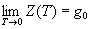
При низких температурах вклад в сумму по
состояниям вносят только уровни с небольшой
энергией (E ~ kT).
4. При T   все
экспоненты, входящие в определение (11.1),
стремятся к 1, поэтому сумма по состояниям
стремится к сумме статистических весов всех
уровней: все
экспоненты, входящие в определение (11.1),
стремятся к 1, поэтому сумма по состояниям
стремится к сумме статистических весов всех
уровней:
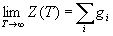 , ,
которая может быть конечной или бесконечной в
зависимости от числа уровней энергии. Пример
системы с конечным пределом суммы по состояниям -
ядерные спины в кристаллах LiF, находящихся во
внешнем магнитном поле.
5. Сумма по состояниям - монотонно возрастающая
функция температуры. Это следует из того, что
производная ( Z/ Z/ T)V,N, рассчитанная из определения (11.1),
положительна при любых температурах.
T)V,N, рассчитанная из определения (11.1),
положительна при любых температурах.
6. Если систему можно разбить на две независимые
друг от друга подсистемы так, что каждый уровень
энергии можно представить в виде суммы: Ei
=Ei1 + Ei2, то сумма по состояниям
разбивается на сомножители (факторизуется): Z
= Z1 Z2, где
функции Z1 и Z2 определены
выражением (11.1), но суммирование в нем
распространяется только на уровни энергии
данной подсистемы. Z2, где
функции Z1 и Z2 определены
выражением (11.1), но суммирование в нем
распространяется только на уровни энергии
данной подсистемы.
7. Главное свойство суммы по состояниям - ее
связь с термодинамическими функциями.
Связь суммы по состояниям с
термодинамическими функциями
Внутреннюю энергию термодинамической системы
можно представить как среднюю энергию по всем
уровням с учетом их заселенности :
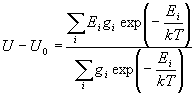 , ,
где U0 - энергия при абсолютном нуле T
= 0. Правую часть этого определения можно
преобразовать с помощью определения суммы по
состояниям (11.1):
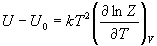 . (11.3) . (11.3)
Таким образом, зная сумму по состояниям, можно
определить внутреннюю энергию как функцию
температуры и объема.
Другое основное соотношение связывает сумму по
состояниям и энергию Гельмгольца:
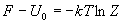 . (11.4) . (11.4)
Дифференцируя функцию F по температуре и
объему, можно найти энтропию и давление:
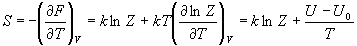 , (11.5) , (11.5)
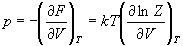 . (11.6) . (11.6)
Последнее соотношение есть не что иное, как
термическое уравнение состояния, т.е.
зависимость давления от объема и температуры.
Пользуясь соотношениями (11.3) - (11.6), можно найти
любые другие термодинамические функции.
Интересно, что все термодинамические функции
определяются не самой суммой по состояниям, а ее
логарифмом.
Молекулярная сумма по состояниям
идеального газа
Многие свойства суммы по состояниям можно
рассмотреть на примере важного частного случая
термодинамической системы - идеального газа.
Сумма по состояниям идеального газа, состоящего
из N одинаковых частиц, может быть выражена
через сумму по состояниям одной частицы Q:
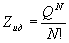 , (11.7) , (11.7)
где множитель 1/N! учитывает квантовый
принцип неразличимости частиц.
Во многих случаях уровни энергии молекулы
идеального газа можно разбить на слагаемые,
соответствующие различным видам движения -
поступательному, вращательному, колебательному,
электронному и ядерному: E = Eпост + Eвр
+ Eкол + Eэл + Eяд,
поэтому молекулярная сумма по состояниям
факторизуется:
Q = Qпост Qвр Qвр Qкол Qкол Qэл Qэл Qяд (11.8) Qяд (11.8)
а) Поступательную сумму по состояниям можно
рассчитать по формуле (11.2) с функцией Гамильтона H(p,q)
= p2 / 2m (m - масса молекулы).
Интегрирование по трем координатам и трем
проекциям импульса производится раздельно и
дает:
Qпост = 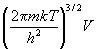 , (11.9) , (11.9)
где V - объем, в котором движется молекула.
б) Вращательная сумма по состояниям зависит от
симметрии молекулы. В простейшем случае, для
линейной молекулы, уровни энергии зависят только
от вращательного квантового числа J: EJ
= hcBJ(J+1), где B - вращательная постоянная
(размерность - см-1), которая определяется
моментом инерции молекулы, c = 3 1010 см/с - скорость света. Каждый
вращательный уровень имеет статистический вес gJ
= 2J + 1. При не очень низких температурах (T
>> B / k) суммирование в (11.1) можно
заменить интегрированием по J, что дает:
1010 см/с - скорость света. Каждый
вращательный уровень имеет статистический вес gJ
= 2J + 1. При не очень низких температурах (T
>> B / k) суммирование в (11.1) можно
заменить интегрированием по J, что дает:
Qвр = 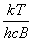 (11.10) (11.10)
Для симметричных молекул это значение надо
поделить на число симметрии (для двухатомных
гомоядерных молекул оно равно 2).
При низких температурах вращательную сумму по
состояниям находят суммированием по нескольким
низшим значениям J.
в) Колебания ядер описывают с помощью модели
гармонического осциллятора, в котором уровни
энергии линейно зависят от колебательного
квантового числа: En = hc n, где n, где  -
частота колебаний (в см-1); энергия
состояния с n = 0 принята за точку отсчета.
Колебательные уровни энергии невырождены,
статистический вес равен 1. Сумма по состояниям
гармонического осциллятора с частотой -
частота колебаний (в см-1); энергия
состояния с n = 0 принята за точку отсчета.
Колебательные уровни энергии невырождены,
статистический вес равен 1. Сумма по состояниям
гармонического осциллятора с частотой  равна: равна:
Q = = 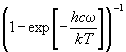 (11.11) (11.11)
Эта сумма заметно отличается от 1 только тогда,
когда дробь в показателе экспоненты меньше 1, т.е.
для температур T > Tкол = hc / k. Последнюю величину
называют эффективной колебательной
температурой для данного колебания. Если
температура ниже колебательной температуры, то
сумма по состояниям почти равна 1. / k. Последнюю величину
называют эффективной колебательной
температурой для данного колебания. Если
температура ниже колебательной температуры, то
сумма по состояниям почти равна 1.
В молекуле, состоящей из n атомов,
происходит 3n-6 (в линейной молекуле - 3n-5)
разных колебаний, каждое - со своей частотой  i, поэтому колебательная
сумма по состояниям молекулы равна произведению
сумм по состояниям для каждого из этих колебаний: i, поэтому колебательная
сумма по состояниям молекулы равна произведению
сумм по состояниям для каждого из этих колебаний:
Qкол = 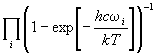 (11.12) (11.12)
г) Электронные и ядерные уровни энергии в
молекуле обычно отстоят очень далеко друг от
друга, и при не слишком высоких температурах
вклад в соответствующую сумму по состояниям
вносит только основной уровень, энергия которого
принимается равной 0. Электронная и ядерная суммы
по состояниям равны статистическим весам
нижнего электронного и ядерного уровня,
соответственно:
Qэл = gэл, Qяд = gяд.
(11.13)
Молекулярные суммы по состояниям для отдельных
видов движения можно использовать для расчета
абсолютных и относительных заселенностей
отдельных энергетических уровней по закону
распределения Больцмана:
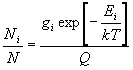 . (11.14) . (11.14)
ПРИМЕРЫ
Пример 11-1. Молекула может находиться на
уровне с энергией 0 или на одном из трех уровней с
энергией E. Найдите молекулярную сумму по
состояниям и рассчитайте зависимость мольной
внутренней энергии от температуры.
Решение. Молекулярная сумма по состояниям
находится просто по определению:
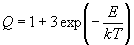
Общая сумма по состояниям связана с
молекулярной соотношением (11.7). Для расчета
мольной внутренней энергии нужна не сама сумма, а
ее логарифм:
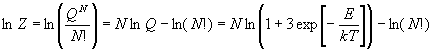
Дифференцируя это выражение по температуре и
используя формулу (11.3), находим:
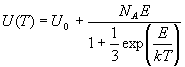
(NA - число Авогадро).
Пример 11-2. Сумма по состояниям некоторой
термодинамической системы, состоящей из N
одинаковых частиц равна:
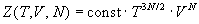 . .
Найдите внутреннюю энергию, энтропию и
уравнение состояния этой системы.
Решение. Найдем логарифм суммы по
состояниям:
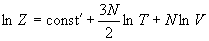
и воспользуемся формулами (11.3), (11.5) и (11.6):
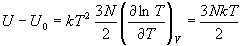 , ,
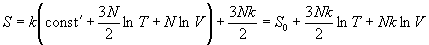 , ,
где S0 не зависит от T и V.
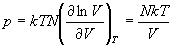
Данная система - идеальный газ.
Пример 11-3. Рассчитайте молекулярную
поступательную сумму по состояниям для N2
при нормальных условиях, если известно, что
молекулярная поступательная сумма по состояниям
для H2 при температуре 298 K и давлении 101.3 кПа
равна 6.70 1028. 1028.
Решение. Поступательная сумма по
состояниям равна:
Qпост = 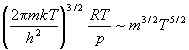
Давление в обоих случаях одинаковое,
различаются только массы молекул и температуры.
Отношение поступательных сумм можно найти по
отношению масс и температур:
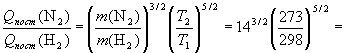 42.1, 42.1,
откуда Qпост(N2) = 42.1  6.70 6.70 1028 = 2.82 1028 = 2.82 1030. 1030.
Пример 11-4. Начиная с какого колебательного
уровня заселенность молекулы хлора ( = 560 см-1) будет меньше 1% при
1000 К? = 560 см-1) будет меньше 1% при
1000 К?
Решение. Используем формулу Больцмана (11.14)
с уровнями энергии En = hc n и колебательной суммой по
состояниям (11.11): n и колебательной суммой по
состояниям (11.11):
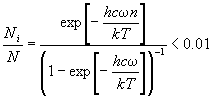 . .
Рассчитаем экспоненту, входящую в это
неравенство:
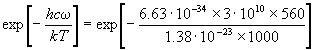 = 0.446. = 0.446.
Решение уравнения
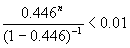
дает n = 4.97  5. 5.
ЗАДАЧИ
11-1. Пусть некоторая молекула существует в
трех состояниях с энергиями, равными 0, E и E.
Найдите выражение для молекулярной суммы по
состояниям Q и мольной внутренней энергии.
11-2. Пусть для некоторой гипотетической
молекулы при больших температурах молекулярная
сумма по состояниям равна: Q = 2 -  /(kT). Найдите выражения для: а)
мольной средней энергии; б) мольной энтропии; в)
мольной изохорной теплоемкости. Объясните,
почему такая молекула не может существовать. /(kT). Найдите выражения для: а)
мольной средней энергии; б) мольной энтропии; в)
мольной изохорной теплоемкости. Объясните,
почему такая молекула не может существовать.
11-3. Статистическая сумма некоторой
термодинамической системы, состоящей из N
одинаковых частиц, равна:
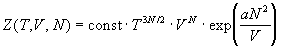 . .
Найдите внутреннюю энергию, энергию
Гельмгольца, энтропию и уравнение состояния этой
системы.
11-4. Даны две термодинамические системы. Для
одной из них известна зависимость внутренней
энергии от температуры: U(T) =  kT + U0, для другой -
зависимость энергии Гельмгольца от температуры: F(T)
= - kT + U0, для другой -
зависимость энергии Гельмгольца от температуры: F(T)
= - kT lnT + U0 ( kT lnT + U0 ( , ,  - постоянные
множители, k - постоянная Больцмана). Найдите
зависимость статистической суммы от температуры
для обеих систем. - постоянные
множители, k - постоянная Больцмана). Найдите
зависимость статистической суммы от температуры
для обеих систем.
11-5. Пользуясь уравнением состояния, найдите
зависимость полной суммы по состояниям
идеального газа и газа Ван-дер-Ваальса от объема.
11-6. Используя связь между суммой по
состояниям и термодинамическими функциями,
выразите производные ( U/ U/ V)T и ( V)T и ( S/ S/ V)T через давление и его
производные. V)T через давление и его
производные.
11-7. Для некоторой термодинамической системы
(не идеального газа) известна сумма по
состояниям, Z(T,V). Найдите работу,
которую выполняет эта система при обратимом
изотермическом расширении от V1 до V2.
11-8. Рассчитайте поступательную сумму по
состояниям O2 при температуре 100 оС и
нормальном давлении, если известно, что
поступательная сумма по состояниям He при
нормальных условиях равна 1.52. 1029.
11-9. Чему равна колебательная сумма по
состояниям иода ( = 214 см-1)
при температуре 1200 К? = 214 см-1)
при температуре 1200 К?
11-10. Рассчитайте молекулярную колебательную
сумму по состояниям оксида углерода (IV) при 1500 K.
Частоты колебаний:  1 = 1388.2
см-1, 1 = 1388.2
см-1,  2 = 667.4 см-1
(двукратное вырождение), 2 = 667.4 см-1
(двукратное вырождение),  3
= 2349.2 см-1. 3
= 2349.2 см-1.
11-11. Рассчитайте вращательную сумму по
состояниям молекулы F2 при температуре 0 оС,
если известно, что вращательная сумма по
состояниям молекулы 35Cl2 при
температуре 298 K равна 424. Межъядерное расстояние
в молекуле фтора в 1.4 раза меньше, чем в молекуле
хлора.
11-12*. Как изменится вращательная сумма по
состояниям, если из каждых (2J+1) уровней с
одинаковой энергией J уровней увеличат свою
энергию на некоторые величины, J уровней
уменьшат энергию на такие же величины, а один
уровень энергии не изменится?
11-13. Рассчитайте вероятность нахождения
молекулы водорода ( = 4400 см-1)
в основном колебательном состоянии при 4000 К. = 4400 см-1)
в основном колебательном состоянии при 4000 К.
11-14. Вычислите вероятность нахождения
атомарной серы в основном и первом возбужденном
электронном состояниях при 1000 К с использованием
следующих данных:
Электронный терм |
Энергия (см-1) |
Статистический вес |
3 P2 |
0 |
5 |
3 P1 |
396.09 |
3 |
3 P0 |
573.65 |
1 |
1 D2 |
9238.58 |
5 |
11-15. Используя данные предыдущей задачи,
рассчитайте электронную сумму по состояниям и
среднюю электронную энергию атома серы при 1000 K.
11-16*. Определите равновесные концентрации
орто- и пара-водорода при температуре 120 K
(вращательная постоянная B = 60.9 см-1).
11-17. Найдите уровень вращательной энергии
молекулы N2 (B = 2.00 см-1), который
имеет самую высокую заселенность при: а) T = 298
K, б) T = 1000 K.
11-18. При какой температуре вращательный
уровень с J =10 в основном электронном и
колебательном состоянии молекулы O2 (B =
1.45 см-1) имеет наибольшую заселенность
среди всех вращательных уровней?
11-19. Рассмотрим заселенность J-го
вращательного уровня двухатомной молекулы как
функцию температуры. При какой температуре эта
заселенность максимальна? (Вращательная
постоянная B).
|

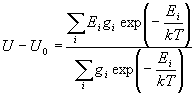 ,
,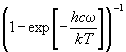 (11.11)
(11.11)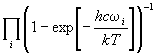 (11.12)
(11.12)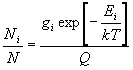 . (11.14)
. (11.14)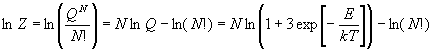
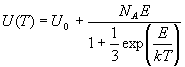
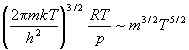
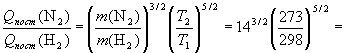 42.1,
42.1,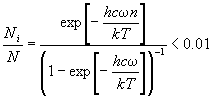 .
.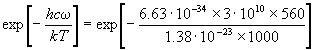 = 0.446.
= 0.446.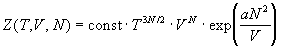 .
.