|
Учебные материалы по физической химии
Задачи по физической химии.Часть 1.Химическая термодинамика
3. Термохимия
Термохимия изучает тепловые эффекты
химических реакций. Во многих случаях эти
реакции протекают при постоянном объеме или
постоянном давлении. Из первого закона
термодинамики следует, что при этих условиях
теплота является функцией состояния. При
постоянном объеме теплота равна изменению
внутренней энергии:
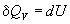 , , 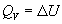 , (3.1) , (3.1)
а при постоянном давлении - изменению
энтальпии:
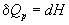 , , 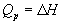 . (3.2) . (3.2)
Эти равенства в применении к химическим
реакциям составляют суть закона Гесса:
Тепловой эффект химической реакции,
протекающей при постоянном давлении или
постоянном объеме, не зависит от пути реакции, а
определяется только состоянием реагентов и
продуктов реакции.
Другими словами, тепловой эффект химической
реакции равен изменению функции состояния.
В термохимии, в отличие от других приложений
термодинамики, теплота считается положительной,
если она выделяется в окружающую среду, т.е. если  H < 0 или H < 0 или  U
< 0. Под тепловым эффектом химической реакции
понимают значение U
< 0. Под тепловым эффектом химической реакции
понимают значение  H
(которое называют просто "энтальпией
реакции") или H
(которое называют просто "энтальпией
реакции") или  U реакции. U реакции.
Если реакция протекает в растворе или в твердой
фазе, где изменение объема незначительно, то
 H = H =  U + U +
 (pV) (pV)   U. (3.3) U. (3.3)
Если же в реакции участвуют идеальные газы, то
при постоянной температуре
 H = H =  U + U +
 (pV) = (pV) =  U + U +
 n . RT, (3.4) n . RT, (3.4)
где  n - изменение числа молей
газов в реакции. n - изменение числа молей
газов в реакции.
Для того, чтобы облегчить сравнение энтальпий
различных реакций, используют понятие
"стандартного состояния". Стандартное
состояние - это состояние чистого вещества при
давлении 1 бар (= 105 Па) и заданной
температуре. Для газов - это
гипотетическое состояние при давлении 1 бар,
обладающее свойствами бесконечно разреженного
газа. Энтальпию реакции между веществами,
находящимися в стандартных состояниях при
температуре T, обозначают 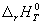 (r означает "reaction"). В
термохимических уравнениях указывают не только
формулы веществ, но и их агрегатные состояния или
кристаллические модификации. (r означает "reaction"). В
термохимических уравнениях указывают не только
формулы веществ, но и их агрегатные состояния или
кристаллические модификации.
Из закона Гесса вытекают важные следствия,
которые позволяют рассчитывать энтальпии
химических реакций.
Следствие 1. Стандартная энтальпия
химической реакции
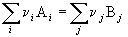
равна разности стандартных энтальпий
образования продуктов реакции и реагентов (с
учетом стехиометрических коэффициентов):
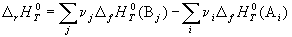 (3.5) (3.5)
Стандартной энтальпией (теплотой)
образования вещества 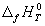 (f означает "formation") при
заданной температуре называют энтальпию реакции
образования одного моля этого вещества из
элементов, находящихся в наиболее устойчивом
стандартном состоянии. Согласно этому
определению, энтальпия образования наиболее
устойчивых простых веществ в стандартном
состоянии равна 0 при любой температуре.
Стандартные энтальпии образования веществ при
температуре 298 К приведены в справочниках. (f означает "formation") при
заданной температуре называют энтальпию реакции
образования одного моля этого вещества из
элементов, находящихся в наиболее устойчивом
стандартном состоянии. Согласно этому
определению, энтальпия образования наиболее
устойчивых простых веществ в стандартном
состоянии равна 0 при любой температуре.
Стандартные энтальпии образования веществ при
температуре 298 К приведены в справочниках.
Понятия "энтальпия образования"
используют не только для обычных веществ, но и
для ионов в растворе. При этом за точку отсчета
принят ион H+, для которого стандартная
энтальпия образования в водном растворе
полагается равной нулю: 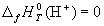
Следствие 2. Стандартная энтальпия
химической реакции
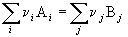
равна разности энтальпий сгорания реагентов и
продуктов реакции (с учетом стехиометрических
коэффициентов):
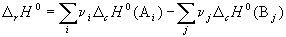 (3.6) (3.6)
(c означает "combustion"). Стандартной
энтальпией (теплотой) сгорания вещества называют
энтальпию реакции полного окисления одного моля
вещества. Это следствие обычно используют для
расчета тепловых эффектов органических реакций.
Следствие 3. Энтальпия химической
реакции равна разности энергий разрываемых и
образующихся химических связей.
Энергией связи A- B называют
энергию, необходимую для разрыва связи и
разведения образующихся частиц на бесконечное
расстояние:
AB(г)  A(г) + B(г). A(г) + B(г).
Энергия связи всегда положительна.
Большинство термохимических данных в
справочниках приведено при температуре 298 К. Для
расчета тепловых эффектов при других
температурах используют уравнение Кирхгофа:
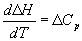 (дифференциальная
форма) (3.7) (дифференциальная
форма) (3.7)
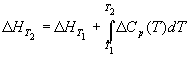 (интегральная форма)
(3.8) (интегральная форма)
(3.8)
где  Cp - разность
изобарных теплоемкостей продуктов реакции и
исходных веществ. Если разница T2 - T1
невелика, то можно принять Cp - разность
изобарных теплоемкостей продуктов реакции и
исходных веществ. Если разница T2 - T1
невелика, то можно принять  Cp
= const. При большой разнице температур необходимо
использовать температурную зависимость Cp
= const. При большой разнице температур необходимо
использовать температурную зависимость  Cp(T) типа: Cp(T) типа:
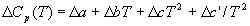 , (3.9) , (3.9)
где коэффициенты a, b, c и т.д. для
отдельных веществ берут из справочника, а знак  обозначает разность между
продуктами и реагентами (с учетом коэффициентов). обозначает разность между
продуктами и реагентами (с учетом коэффициентов).
ПРИМЕРЫ
Пример 3-1. Стандартные энтальпии
образования жидкой и газообразной воды при 298 К
равны -285.8 и -241.8 кДж/моль, соответственно.
Рассчитайте энтальпию испарения воды при этой
температуре.
Решение. Энтальпии образования
соответствуют следующим реакциям:
H2(г) + ЅO2(г) = H2O(ж),  H10 = -285.8; H10 = -285.8;
H2(г) + ЅO2(г) = H2O(г),  H20 = -241.8. H20 = -241.8.
Вторую реакцию можно провести в две стадии:
сначала сжечь водород с образованием жидкой воды
по первой реакции, а затем испарить воду:
H2O(ж) = H2O(г),  H0исп = ? H0исп = ?
Тогда, согласно закону Гесса,
 H10 + H10 +  H0исп = H0исп =  H20, H20,
откуда  H0исп =
-241.8 - (-285.8) = 44.0 кДж/моль. H0исп =
-241.8 - (-285.8) = 44.0 кДж/моль.
Ответ. 44.0 кДж/моль.
Пример 3-2. Рассчитайте энтальпию реакции
6C(г) + 6H(г) = C6H6(г)
а) по энтальпиям образования; б) по энергиям
связи, в предположении, что двойные связи в
молекуле C6H6 фиксированы.
Решение. а) Энтальпии образования (в
кДж/моль) находим в справочнике (например, P.W.Atkins,
Physical Chemistry, 5th edition, pp. C9-C15):  fH0(C6H6(г))
= 82.93, fH0(C6H6(г))
= 82.93,  fH0(C(г))
= 716.68, fH0(C(г))
= 716.68,  fH0(H(г))
= 217.97. Энтальпия реакции равна: fH0(H(г))
= 217.97. Энтальпия реакции равна:
 rH0 = 82.93 - 6 rH0 = 82.93 - 6 716.68 - 6 716.68 - 6 217.97 = -5525
кДж/моль. 217.97 = -5525
кДж/моль.
б) В данной реакции химические связи не
разрываются, а только образуются. В приближении
фиксированных двойных связей молекула C6H6
содержит 6 связей C- H, 3 связи C- C и 3 связи C=C.
Энергии связей (в кДж/моль) (P.W.Atkins, Physical Chemistry, 5th
edition, p. C7): E(C- H) = 412, E(C- C) = 348, E(C=C) = 612.
Энтальпия реакции равна:
 rH0 = -(6 rH0 = -(6 412 + 3 412 + 3 348 + 3 348 + 3 612) = -5352 кДж/моль. 612) = -5352 кДж/моль.
Разница с точным результатом -5525 кДж/моль
обусловлена тем, что в молекуле бензола нет
одинарных связей C- C и двойных связей C=C, а есть 6
ароматических связей C C. C.
Ответ. а) -5525 кДж/моль; б) -5352 кДж/моль.
Пример 3-3. Пользуясь справочными данными,
рассчитайте энтальпию реакции
3Cu(тв) + 8HNO3(aq) = 3Cu(NO3)2(aq)
+ 2NO(г) + 4H2O(ж)
при 298 К.
Решение. Сокращенное ионное уравнение
реакции имеет вид:
3Cu(тв) + 8H+(aq) + 2NO3-(aq)
= 3Cu2+(aq) + 2NO(г) + 4H2O(ж).
По закону Гесса, энтальпия реакции равна:
 rH0 = 4 rH0 = 4 fH0(H2O(ж))
+ 2 fH0(H2O(ж))
+ 2 fH0(NO(г)) +
3 fH0(NO(г)) +
3 fH0(Cu2+(aq))
- 2 fH0(Cu2+(aq))
- 2 fH0(NO3-(aq)) fH0(NO3-(aq))
(энтальпии образования меди и иона H+
равны, по определению, 0). Подставляя значения
энтальпий образования (P.W.Atkins, Physical Chemistry, 5th edition,
pp. C9-C15), находим:
 rH0 = 4 rH0 = 4 (-285.8) + 2 (-285.8) + 2 90.25 + 3 90.25 + 3 64.77 - 2 64.77 - 2 (-205.0) = -358.4 кДж (-205.0) = -358.4 кДж
(в расчете на три моля меди).
Ответ. -358.4 кДж.
Пример 3-4. Рассчитайте энтальпию сгорания
метана при 1000 К, если даны энтальпии образования
при 298 К:  fH0(CH4)
= -17.9 ккал/моль, fH0(CH4)
= -17.9 ккал/моль,  fH0(CO2)
= -94.1 ккал/моль, fH0(CO2)
= -94.1 ккал/моль,  fH0(H2O(г))
= -57.8 ккал/моль. Теплоемкости газов (в кал/(моль.
К)) в интервале от 298 до 1000 К равны: fH0(H2O(г))
= -57.8 ккал/моль. Теплоемкости газов (в кал/(моль.
К)) в интервале от 298 до 1000 К равны:
Cp(CH4) = 3.422 + 0.0178. T,
Cp(O2) = 6.095 + 0.0033. T,
Cp(CO2) = 6.396 + 0.0102. T,
Cp(H2O(г)) = 7.188 + 0.0024. T.
Решение. Энтальпия реакции сгорания метана
CH4(г) + 2O2(г) = CO2(г) + 2H2O(г)
при 298 К равна:
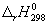 = -94.1 + 2 = -94.1 + 2 (-57.8) - (-17.9) = -191.8 ккал/моль. (-57.8) - (-17.9) = -191.8 ккал/моль.
Найдем разность теплоемкостей как функцию
температуры:
 Cp = Cp(CO2)
+ 2 Cp = Cp(CO2)
+ 2 Cp(H2O(г)) - Cp(CH4)
- 2 Cp(H2O(г)) - Cp(CH4)
- 2 Cp(O2) = Cp(O2) =
= 5.16 - 0.0094T (кал/(моль. К)).
Энтальпию реакции при 1000 К рассчитаем по
уравнению Кирхгофа:
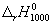 = = 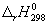 + + 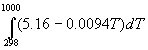 = -191800 + 5.16 = -191800 + 5.16
 (1000-298) - 0.0094 (1000-298) - 0.0094 (10002-2982)/2
= -192500 кал/моль. (10002-2982)/2
= -192500 кал/моль.
Ответ. -192.5 ккал/моль.
ЗАДАЧИ
3-1. Сколько тепла потребуется на перевод 500 г Al
(т.пл. 658 оС,  H0пл
= 92.4 кал/г), взятого при комнатной температуре, в
расплавленное состояние, если Cp(Alтв)
= 0.183 + 1.096 H0пл
= 92.4 кал/г), взятого при комнатной температуре, в
расплавленное состояние, если Cp(Alтв)
= 0.183 + 1.096 10-4T кал/(г 10-4T кал/(г К)? К)?
3-2. Стандартная энтальпия реакции CaCO3(тв)
= CaO(тв) + CO2(г), протекающей в открытом
сосуде при температуре 1000 К, равна 169 кДж/моль.
Чему равна теплота этой реакции, протекающей при
той же температуре, но в закрытом сосуде?
3-3. Рассчитайте стандартную внутреннюю
энергию образования жидкого бензола при 298 К,
если стандартная энтальпия его образования
равна 49.0 кДж/моль.
3-4. Рассчитайте энтальпию образования N2O5(г)
при T = 298 К на основании следующих данных:
2NO(г) + O2(г) = 2NO2(г),  H10
= -114.2 кДж/моль, H10
= -114.2 кДж/моль,
4NO2(г) + O2(г) = 2N2O5(г),  H20 = -110.2 кДж/моль, H20 = -110.2 кДж/моль,
N2(г) + O2(г) = 2NO(г),  H30
= 182.6 кДж/моль. H30
= 182.6 кДж/моль.
3-5. Энтальпии сгорания  -глюкозы, -глюкозы,
 -фруктозы и сахарозы при 25 оС
равны -2802, -фруктозы и сахарозы при 25 оС
равны -2802,
-2810 и -5644 кДж/моль, соответственно. Рассчитайте
теплоту гидролиза сахарозы.
3-6. Определите энтальпию образования
диборана B2H6(г) при T = 298 К из
следующих данных:
B2H6(г) + 3O2(г) = B2O3(тв)
+ 3H2O(г),  H10 =
-2035.6 кДж/моль, H10 =
-2035.6 кДж/моль,
2B(тв) + 3/2 O2(г) = B2O3(тв),  H20 = -1273.5 кДж/моль, H20 = -1273.5 кДж/моль,
H2(г) + 1/2 O2(г) = H2O(г),  H30 = -241.8 кДж/моль. H30 = -241.8 кДж/моль.
3-7. Рассчитайте теплоту образования сульфата
цинка из простых веществ при T = 298 К на
основании следующих данных:
ZnS = Zn + S,  H10 = 200.5
кДж/моль, H10 = 200.5
кДж/моль,
2ZnS + 3O2 = 2ZnO + 2SO2,  H20
= -893.5 кДж, H20
= -893.5 кДж,
2SO2 + O2 = 2SO3,  H30
= -198.2 кДж/моль, H30
= -198.2 кДж/моль,
ZnSO4 = ZnO + SO3,  H40
= 235.0 кДж/моль. H40
= 235.0 кДж/моль.
3-8. Найдите  rH0298
для реакции rH0298
для реакции
CH4 + Cl2 = CH3Cl(г) + HCl(г),
если известны теплоты сгорания метана ( cH0(CH4) = -890.6
кДж/моль), хлорметана ( cH0(CH4) = -890.6
кДж/моль), хлорметана ( cH0(CH3Cl)
= -689.8 кДж/моль), водорода ( cH0(CH3Cl)
= -689.8 кДж/моль), водорода ( cH0(H2)
= -285.8 кДж/моль) и теплота образования HCl ( cH0(H2)
= -285.8 кДж/моль) и теплота образования HCl ( fH0(HCl) = -92.3
кДж/моль)). fH0(HCl) = -92.3
кДж/моль)).
3-9. Рассчитайте тепловой эффект реакции
NH3 + 5/4 O2 = NO + 3/2 H2O(г)
при T = 298 K, если известны следующие данные:
H2O(г) = H2O(ж),  H10 = -44 кДж/моль, H10 = -44 кДж/моль,
1/2N2 + 3/2H2 = NH3,  H20
= -46.2 кДж/моль, H20
= -46.2 кДж/моль,
H2 + 1/2O2 = H2O(ж),  H30 = -285.8 кДж/моль, H30 = -285.8 кДж/моль,
NO = 1/2N2 + 1/2O2,  H40
= -91.3 кДж/моль. H40
= -91.3 кДж/моль.
3-10. При взаимодействии 10 г металлического
натрия с водой  rH298
= -79.91 кДж, а при взаимодействии 20 г оксида натрия с
водой rH298
= -79.91 кДж, а при взаимодействии 20 г оксида натрия с
водой  rH298 = -76.76
кДж. Вода берется в большом избытке. Рассчитайте
теплоту образования оксида натрия rH298 = -76.76
кДж. Вода берется в большом избытке. Рассчитайте
теплоту образования оксида натрия  fH0298(Na2O),
если fH0298(Na2O),
если  fH0298(H2Oж)
= -285.8 кДж/моль. fH0298(H2Oж)
= -285.8 кДж/моль.
3-11. Энергия связи в молекуле H2 равна 432.1
кДж/моль, а энергия связи в молекуле N2 равна
945.3 кДж/моль. Какова энтальпия атомизации
аммиака, если энтальпия образования аммиака
равна -46.2 кДж/моль?
3-12. Рассчитайте стандартный тепловой эффект
реакции нейтрализации
NaOH + HCl = NaCl + H2O,
протекающей в водном растворе при 298 К.
3-13. Рассчитайте стандартный тепловой эффект
реакции
CaSO4(тв) + Na2CO3(aq) = CaCO3(тв)
+ Na2SO4(aq)
при 298 К.
3-14. Напишите уравнение Кирхгофа для реакции,
протекающей при постоянном объеме.
3-15. Зависимость теплового эффекта реакции CH3OH(г)
+ 3/2O2 = CO2 + 2H2O(г) от
температуры выражается уравнением:
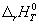 (Дж) = (Дж) =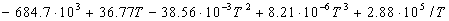
Рассчитайте изменение теплоемкости  Cp для этой реакции при 500
К. Cp для этой реакции при 500
К.
3-16. Стандартная энтальпия образования Al2O3(тв)
при 298 К равна -1675 кДж/моль. Рассчитайте
стандартную энтальпию образования Al2O3(тв)
при 800 К, если даны мольные теплоемкости (в
Дж/(моль. К)):
Cp(Al) = 20.67 + 12.39. 10-3T, Cp(O2)
= 31.46 + 3.39. 10-3T - 3.77. 105T-2,
Cp(Al2O3) = 114.56 + 12.89. 10-3T
- 34.31. 105T -2.
3-17. Энтальпия диссоциации карбоната кальция
при 900 оС и давлении 1 атм равна 178 кДж/моль.
Выведите уравнение зависимости энтальпии
реакции от температуры и рассчитайте количество
теплоты, поглощенное при разложении 1 кг
карбоната кальция при 1000 оС и 1 атм, если
даны мольные теплоемкости (в Дж/(моль. К)):
Cp(СaCO3(тв)) = 104.5 + 21.92. 10-3T
- 25.94. 105T-2,
Cp(СaO(тв)) = 49.63 + 4.52. 10-3T
- 6.95. 105T-2,
Cp(CO2(г)) = 44.14 + 9.04. 10-3T
- 8.53. 105T-2.
|

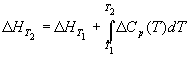 (интегральная форма)
(3.8)
(интегральная форма)
(3.8)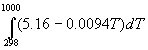 = -191800 + 5.16
= -191800 + 5.16