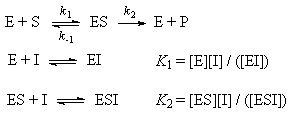|
Учебные материалы по физической химии
Задачи по физической химии.Часть 2.Химическая кинетика. Электрохимия
7. Ферментативный катализ
Во многих случаях скорость реакции резко
изменяется в присутствии специальных веществ - катализаторов.
Катализаторы участвуют в реакции, но в
результате ее не расходуются. Катализаторы
биологических процессов, протекающих в живых
организмах, представляют собой белковые
молекулы, которые называют ферментами, или
энзимами.
Простейшая схема ферментативного катализа
включает обратимое образование промежуточного
комплекса фермента (E) с реагирующим веществом (субстратом,
S) и разрушение этого комплекса с образованием
продуктов реакции (P):
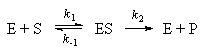
Применение квазиравновесного приближения к
этой схеме (при условии k2 << k-1)
с учетом уравнения материального баланса [E] = [E]0
- [ES] (индекс "0" обозначает начальную
концентрацию) позволяет выразить скорость
образования продукта через начальную
концентрацию фермента и текущую концентрацию
субстрата:
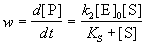 , ,
где KS = k-1 / k1 = [E]. [S] /
[ES] - субстратная константа. При увеличении
концентрации субстрата скорость реакции
стремится к предельному значению: wmax = k2.
[E]0. Скорость реакции связана с
максимальной скоростью соотношением:
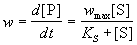 . (7.1) . (7.1)
Обычно в эксперименте измеряют зависимость
начальной скорости ферментативной реакции от
начальной концентрации субстрата: w0 = f([S]0).
Проведение таких измерений для ряда начальных
концентраций позволяет определить параметры
уравнения (7.1) - KS и wmax.
Чаще всего для анализа кинетических схем
ферментативного катализа используют метод
стационарных концентраций (k2 >> k1).
Применение этого метода к простейшей схеме
катализа дает уравнение Михаэлиса-Ментен:
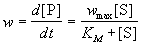 , (7.2) , (7.2)
где wmax = k2. [E]0
- максимальная скорость реакции (при бесконечно
большой концентрации субстрата),
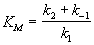
- константа Михаэлиса. Эта константа равна
концентрации субстрата, при которой скорость
реакции равна половине максимальной скорости.
Типичные значения KM - от 10-6 до 10-1
моль/л. Константу скорости k2 иногда
называют числом оборотов фермента. Она может
изменяться в пределах от 10 до 108 мин-1.
Уравнение (7.2) можно записать в других
координатах, более удобных для обработки
экспериментальных данных:
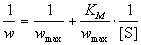 (7.2а) (7.2а)
(координаты Лайнуивера-Берка) или
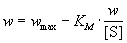 . (7.2б) . (7.2б)
Для определения параметров KM и wmax
по уравнениям (7.2а) и (7.2б) проводят серию
измерений начальной скорости реакции от
начальной концентрации субстрата и представляют
экспериментальные данные в координатах 1/w0
ё 1/[S]0 или w0 ё w0/[S]0.
Иногда течение ферментативной реакции
осложняется присутствием ингибиторов -
веществ, способных образовывать комплексы с
ферментом или фермент-субстратным комплексом.
Различают конкурентное, неконкурентное и
смешанное ингибирование.
При конкурентном механизме ингибитор (I)
конкурирует с субстратом за активные участки
фермента. Простейшая кинетическая схема данного
процесса имеет вид:
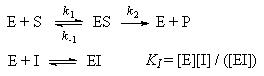
Применение квазистационарного приближения к
комплексу ES и квазиравновесного приближения к
комплексу EI с учетом уравнений материального
баланса [E] + [ES] + [EI] = [E]0 и [I] " [I]0 дает
для скорости реакции уравнение типа (7.2):
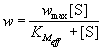 , (7.3) , (7.3)
где эффективная константа Михаэлиса связана с
исходной концентрацией ингибитора:
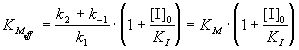 ; (7.3а) ; (7.3а)
Величину KI = [E]. [I] / [EI], которая
представляет собой константу диссоциации
комплекса фермента с ингибитором, называют
константой ингибирования. Таким образом, при
конкурентном ингибировании увеличивается
константа Михаэлиса, а максимальная скорость
ферментативной реакции остается неизменной.
При неконкурентном механизме ингибитор
обратимо связывает промежуточный комплекс
фермента с субстратом. Простейшая кинетическая
схема данного процесса имеет вид:
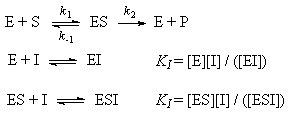 , ,
где предполагается, что константы диссоциации
комплексов EI и ESI одинаковы: [E]. [I] / [EI] = [ES]. [I] / [ESI] = KI.
Применение квазистационарного приближения к
комплексу ES и квазиравновесного приближения к
комплексам EI и ESI с учетом уравнений
материального баланса [E] + [ES] + [EI] + [ESI] = [E]0 и
[I] " [I]0 дает для скорости реакции
уравнение типа (7.2):
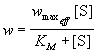 , (7.4) , (7.4)
где эффективная максимальная скорость связана
с начальной концентрацией ингибитора
выражением:
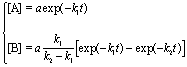 . (7.4а) . (7.4а)
При неконкурентном ингибировании максимальная
скорость реакции уменьшается, а константа
Михаэлиса остается неизменной.
Смешанное ингибирование описывается более
сложными кинетическими схемами. При смешанном
ингибировании изменяются и константа Михаэлиса,
и максимальная скорость ферментативной реакции.
ПРИМЕРЫ
Пример 7-1. Найдите константу Михаэлиса и
максимальную скорость гидролиза
аденозинтрифосфата, катализируемого миозином,
по следующим кинетическим данным:
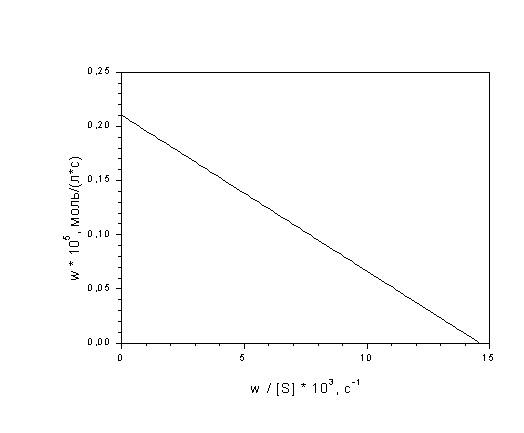
Решение. Уравнение Михаэлиса-Ментен в данных
координатах имеет вид (7.2б), следовательно, точки
пересечения с осями имеют координаты: (0;wmax)
для оси ординат, (wmax/KM;0) для
оси абсцисс. Первая точка пересечения дает
значение wmax = 2.1. 10-6 моль/(л.
с). Вторая точка позволяет найти константу
Михаэлиса: wmax/KM = 14.6.10-3
с-1, KM = 2.1. 10-6 / 14.6.10-3
= 1.44.10-4 моль/л.
Пример 7-2. Ферментативная реакция (KM
= 2.7.10-3 моль/л) подавляется
конкурентным ингибитором (KI = 3.1.10-5
моль/л). Концентрация субстрата равна 3.6. 10-4
моль/л. Сколько ингибитора понадобится для
подавления реакции на 65%? Во сколько раз надо
повысить концентрацию субстрата, чтобы
уменьшить степень подавления до 25%?
Решение. 1) Конкурентное ингибирование
описывается формулами (7.3) и (7.3а). 65%-ное
подавление реакции означает, что скорость
ингибируемой реакции составляет 35% от скорости
реакции в отсутствие ингибитора:
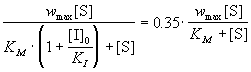 , ,
откуда следует, что
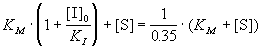 . .
В этой формуле известны значения KM, KI
и [S]. Концентрация ингибитора равна:
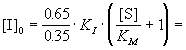 6.5. 10-5
моль/л. 6.5. 10-5
моль/л.
Уменьшение степени ингибирования до 25%
означает, что скорость ингибируемой реакции
составляет 75% от нормальной:
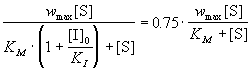 , ,
где в данном случае известны KM, KI
и [I]0. Отсюда можно выразить искомую
концентрацию субстрата:
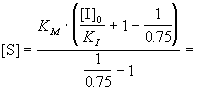 1.4.10-2
моль/л. 1.4.10-2
моль/л.
Таким образом, для уменьшения степени
ингибирования до 25% концентрацию субстрата надо
увеличить в 1.4. 10-2 / 3.6.10-4 =
40 раз.
ЗАДАЧИ
7-1. Гидролиз ацетилхолина катализируется
ферментом ацетилхолинэстеразой, число оборотов
которой составляет 25000 с-1. Сколько времени
потребуется ферменту для расщепления одной
молекулы ацетилхолина? (ответ)
7-2. Для некоторой ферментативной реакции
константа Михаэлиса равна 0.035 моль/л. Скорость
реакции при концентрации субстрата 0.110 моль/л
равна 1.15.10-3 моль/(л. с). Найдите
максимальную скорость этой реакции.(ответ)
7-3. Начальная скорость окисления сукцината
натрия в фумарат натрия под действием фермента
сукциноксидазы была измерена для ряда
концентраций субстрата:
| [S], моль/л |
0.01 |
0.002 |
0.001 |
0.0005 |
0.00033 |
| w.106, моль/(л. с) |
1.17 |
0.99 |
0.79 |
0.62 |
0.50 |
Определите константу Михаэлиса данной реакции.(ответ)
7-4. Начальная скорость выделения O2 при
действии фермента на субстрат была измерена для
ряда концентраций субстрата:
| [S], моль/л |
0.050 |
0.017 |
0.010 |
0.005 |
0.002 |
| w, мм3/мин |
16.6 |
12.4 |
10.1 |
6.6 |
3.3 |
Определите константу Михаэлиса данной реакции.(ответ)
7-5. Найдите константу Михаэлиса и
максимальную скорость каталитического
разложения гидроперекиси тетралина по следующим
кинетическим данным:
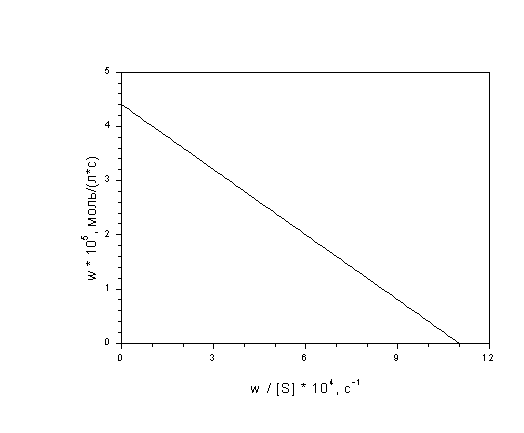
(ответ)
7-6. Найдите константу Михаэлиса и
максимальную скорость каталитического
окисления циклогексена трет-бутилпероксидом
по следующим кинетическим данным:
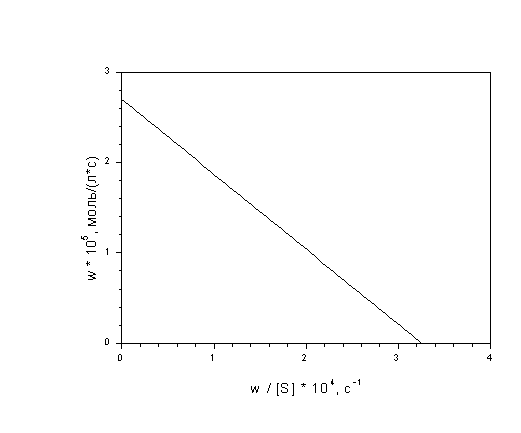
(ответ)
7-7. Найдите константу Михаэлиса и
максимальную скорость гидролиза
карбобензилоксиглицилфенилаланина под
действием карбоксипептидазы по следующим
кинетическим данным:
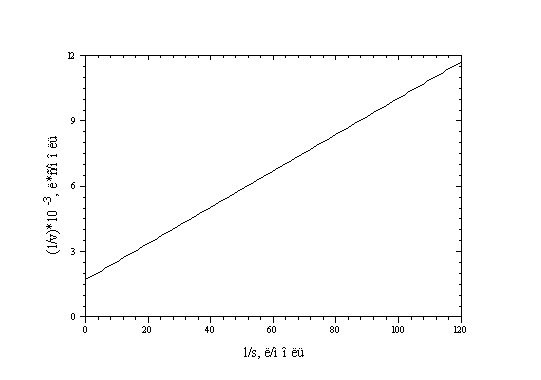
(ответ)
7-8. Рассчитайте концентрацию
неконкурентного ингибитора I (KI = 2.9.10-4
моль/л), необходимую для 90%-ного подавления
ферментативной реакции.(ответ)
7-9. В некоторых случаях кинетические
исследования ферментативных реакций проводят в
условиях избытка фермента. Выведите уравнение
Михаэлиса-Ментен, описывающее зависимость начальной
скорости ферментативной реакции от начальных
концентраций фермента и субстрата в системе
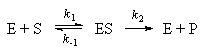
при условии, что концентрация фермента намного
больше концентрации субстрата.(ответ)
*7-10. Рассмотрите механизм ферментативного
катализа с двумя промежуточными комплексами:
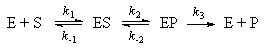
Используя метод квазистационарных
концентраций и уравнение материального баланса,
покажите, что скорость реакции описывается
уравнением типа Михаэлиса-Ментен (7.2). Найдите
выражения для эффективной максимальной скорости
и эффективной константы Михаэлиса через
константы скорости отдельных стадий.(ответ)
7-11. Запишите уравнения конкурентного и
неконкурентного ингибирования в координатах
Лайнуивера-Берка. Представьте эти уравнения в
графическом виде для трех разных начальных
концентраций ингибитора (включая [I]0 = 0).
Объясните, как можно определить константу
ингибирования.(ответ)
7-12. Запишите уравнения конкурентного и
неконкурентного ингибирования в координатах w0
 w0/[S]0.
Представьте эти уравнения в графическом виде для
трех разных начальных концентраций ингибитора
(включая [I]0 = 0). Объясните, как можно
определить константу ингибирования.(ответ) w0/[S]0.
Представьте эти уравнения в графическом виде для
трех разных начальных концентраций ингибитора
(включая [I]0 = 0). Объясните, как можно
определить константу ингибирования.(ответ)
*7-13. Рассмотрите схему неконкурентного
ингибирования с разными константами диссоциации
комлпексов:
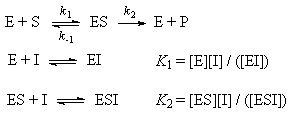
Используя квазистационарное приближение для ES
и квазиравновесное приближение для EI и ESI,
найдите начальную скорость реакции. Как связаны
максимальная скорость реакции и константа
Михаэлиса с соответствующими величинами для
неингибируемой реакции?(ответ)
|

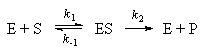
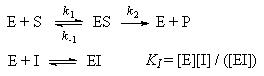
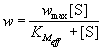 , (7.3)
, (7.3)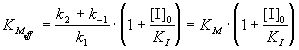 ; (7.3а)
; (7.3а)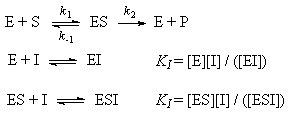 ,
,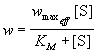 , (7.4)
, (7.4)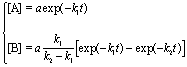 . (7.4а)
. (7.4а)
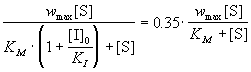 ,
,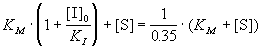 .
.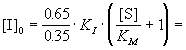 6.5. 10-5
моль/л.
6.5. 10-5
моль/л.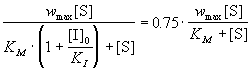 ,
,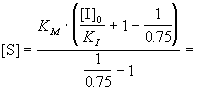 1.4.10-2
моль/л.
1.4.10-2
моль/л.