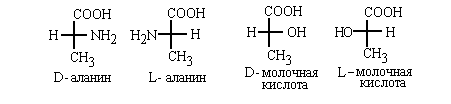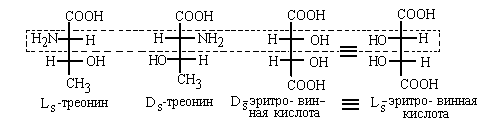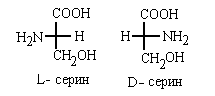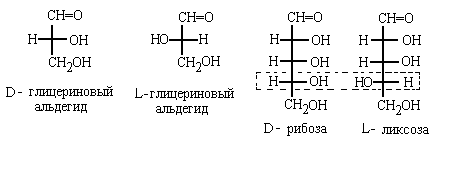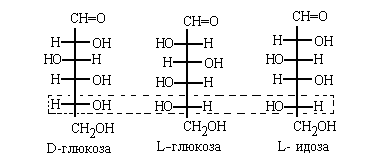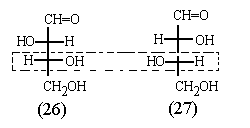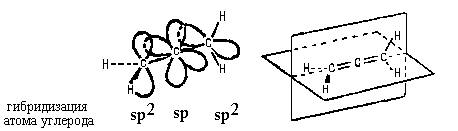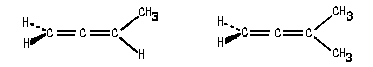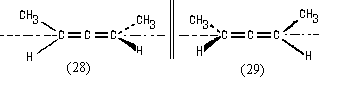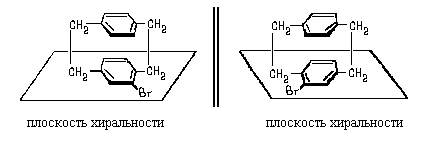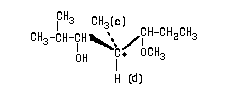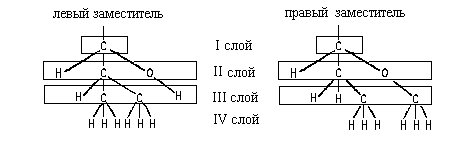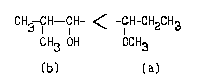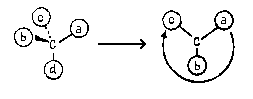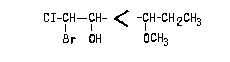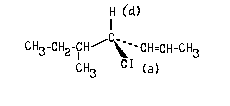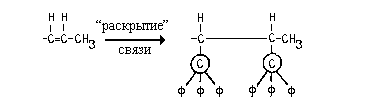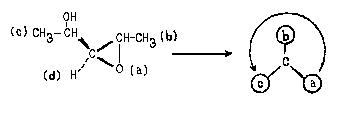|
Учебные материалы/ органическая химия
В.П.Дядченко "Введение в стереохимию"
4.D, L -Система обозначения стереоизомеров.
В ряде случаев предпочитают пользоваться не R,S
-системой обозначения абсолютной конфигурации, а
другой, D,L -системой. Выбор D или L обоpyачения
изомера основан на определенном расположении регерной
группы в проекции Фишера. D , L
-Номенклатура широко используется в названиях  -амино, -амино,  -гидроксикислот и
углеводов. -гидроксикислот и
углеводов.
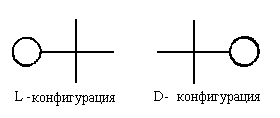
По этой системе L -конфигурация приписывается
стереозомеру, у которого в проекций Фишера
реперная группа находится слева от вертикальной
линии (от лат. "laevus" -левый). Соответственно,
если реперная группа расположена в
проекции Фишера справа, стереоизомер имеет D -
конфигурацию (от лат. "dexter" - правый):
Конечно, надо помнить, что в проекции Фишера
вверху располагает наиболее окисленный атом
углерода (то есть, группу СООН в амино- и
гидроксилкслотах и группу СН=О в углеводах).
Амино и гидроксикислоты
В  -амино- и
-амино- и  -гидроксикислотах реперными
группами служат, соответственно, группы NH2
и ОН: -гидроксикислотах реперными
группами служат, соответственно, группы NH2
и ОН:
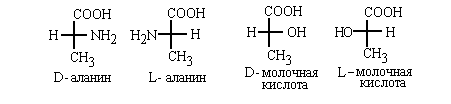
Если в амино- или гидроксикислоте есть
несколько амино- или гидрокси-групп, то указывают
их взаимное расположение, пользуясь приставками
"эритро", "трео" и.п. Отнесение кислоты к
D- или L-ряду при этом определяет NH2
или ОН-группа, находящаяся в  - положении к
СООН-группе, расположенной вверху в проекции
Фишера: - положении к
СООН-группе, расположенной вверху в проекции
Фишера:
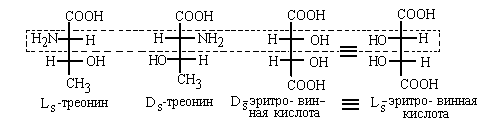
В этом случае буквы D и L, указывающие
положение реперной группы, снабжены индексом
"S". Это делается во избежание путаницы.
Индекс "S" подчеркивает, что указана
конфигурация именно верхнего хирального
центра, находящегося относительно карбоксильной
группы в  - положении , как и в
аминокислоте серине ("S" - от слова
"serine"). - положении , как и в
аминокислоте серине ("S" - от слова
"serine").
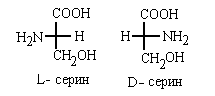
Для гидроксикислот с несколькими ОН-группами, а
также аминогидроксикислот используют и
альтернативный вариант обозначения
конфигурации, в котором реперной группой
является самая нижняя в проекции Фишера НО-
группа. При этом конфигурационные дескрипторы D
и L снабжаются подстрочным индексом "g" (от
"glyceric aldehyde"). В этом случае изображенные на
рис.123 и 124 аминокислоты получают названия: Dg
-треонин ( Ls- треонин) и Lg-треонин
( Ls- треонин) и Lg-треонин
(  Ds-треонин). Ds-треонин).
Углеводы.
В углеводах реперной группой является самая
нижняя в проекции Фишера гидроксильная
группа, связанная с аиммтрическим атомом
углерода
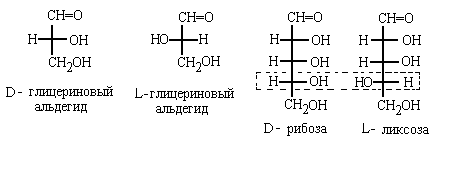
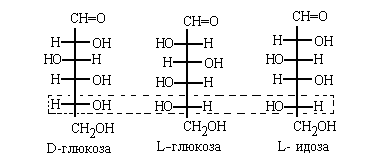
Очевидно, что в случае молекул с одним
асимметрическим атомом D,L -номенклатура, как
и R,S -номенклатура однозначно говорит об
абсолютной конфигурации центра хиральности. То
же самое относится к применению D,L -наименования
стереоизомеров с несколькими асимметрическими
атомами, поскольку в этом случае конфигурация
остальных центров хиральности задается
приставками эритро-, трео-, рибо-, ликсо- и т.п.
Так, если мы скажем "треоза", то зададим
только относительную конфигурацию
асимметрических атомов в молекуле. Тогда будет
неясно, о каком именно энантиомере идет речь: (26)
или (27), Если же мы скажем "D-треоза", то
однозначно укажем, что имеется в виду изомер (26),
поскольку в нем реперная группа ОН расположена
справа в проекции Фишера:
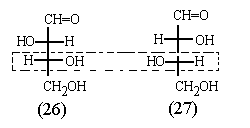
Таким образом, название "D-треоза" (как и
"L-треоза") говорит об абсолютной
конфигурации обоих асимметрических атомов в
молекуле.
Как и R,S -номенклатура, D,L-система обозначения
стереоизомеров не связана со знаком оптического
вращения.
Следует отметить, что ранее для обозначения
направления вращения плоскости поляризации
света использовались строчные буквы d (вправо)
и l (влево). Не следует путать применение
этих букв с использованием прописных букв D и
L для обозначения конфигурации молекул. В
настоящее время направление вращения плоскости
поляризации света принято обозначать
символами (+) и (-).
5.Хиральные молекулы без
асимметрических атомов
В предыдущих разделах были рассмотрены
молекулы, хиральность которых обусловлена
определенным npocтранственным расположением
четырех разных атомов или групп атомов
относительно некоторого центра, называемого
центром хиральности.
Возможны случаи, когда подобных центров в
молекуле нет, но тем не менее молекула хиральна,
поскольку в ней отсутствуют элементы симметрии
группы Sn. В таких случаях энантиомеры
различаются расположением атомов относительно
некоторой оси или плоскости, которые называют
осью хиральности или плоскостью хиральностию.
Ось хиральности встречается, например, в
молекулах кумуленов.
Строение молекулы простейшего кумулена - аллена -
такого, что два его фрагмента СН2
находятся в двух взаимно перлендикулярных
плоскостях:
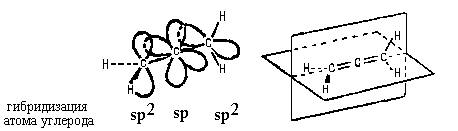
Молекула аллена ахиральна: в ней есть две
плоскости симметрии (показаны на рисунке).
Ахиральны также молекулы бутадиена-1,2 и
3-метил-бутадиена-1,2
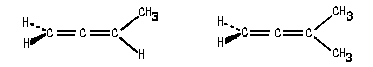
Если же мы рассмотрим молекулу пентадиена-2,3, то
увидим, что в ней нет плоскостей симметрии (как
нет и других элементов симметрии группы Sn).
Этот диен существует в виде пары энантиомеров:
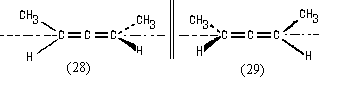
Хиральность молекул (28) и (29) обусловлена
определенным простарственным расположением
заместителей относительно оси (показана на
рисунке), проходящей через атомы углерода,
связанные двойными связями. Эту ось называют осью
хиральности. О молекулах, подобных (28) и (29)
говорят, что они обладают осевой хиральностью.
Оси хиральности имеются и в молекулах
некоторых других соединений, например,
спиросоединениях (спиранах):
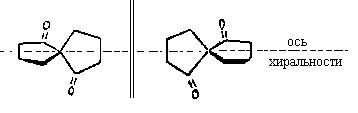
Упомянутые антропоизомеры
орто-дизамещенных бифениловтакже представляют
собой молекулы с осевой хиральностью.Примерами
молекул с плоскостью хиральности могут
служить молекулы пара-циклофанов:
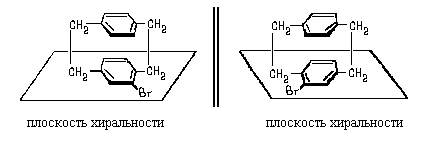
Изображенные здесь энантиомеры не могут
превратиться друг в друга за счет поворота
вокруг  -связей в силу пространственых
требованй входящих в состав этих молекул
фрагментов. -связей в силу пространственых
требованй входящих в состав этих молекул
фрагментов.
Для обозначения конфигурации молекул с осевой
и плоскостной хиральностью можно использовать
R,S-номенклатуру. Интересующиеся могут найти
описание принципов отнесения конфигурации к R
или S для таких молекул в издании ВИНИТИ:
Hoмeнклатурные правила ИЮПАК по химии, т.3,
полутом2, М., 1983.
6.К правилу последовательности в
R,S - номенклатуре.
В ряде случаев при определении порядка
старшинства заместителей встречаются
осложнения.Рассмотрим некоторые из них.
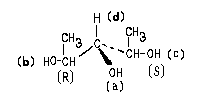
Пример 1.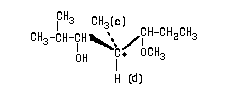
Очевидно, что в данном случае младшими
заместителями при асимметрическом атоме
углерода, отмеченном звездочкой, являются Н (d) и
СН3 (с). Рассмотрим два оставшихся сложных
заместителя, расположив в них атомы по слоям.
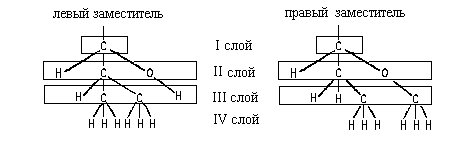
В первом слое обоих заместителей атомы
одинаковы. Во втором слое набор атомов также
одинаков. (Н,С,О). Поэтому нам необходимо
обратиться к третьему слою атомов. При этом в
левом и правом заместителях следует в первую очередь сравнивать атомы Ш слоя,
связанные со старшими атомами II- слоя (то
есть рассматривать "старшие ветви"
обоих заместителей). В данном случае речь идет об
атома, связанных с атомом кислорода П слоя.
Поскольку в правом заместителе с атомом
кислорода связан атом С, а в левом - атом Н,
правый заместитель получает преимущество в
сташинстве:
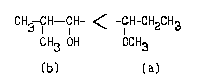
Соединению следует приписать R-конфигурацию:
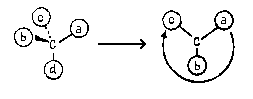
Если бы атомы "старшей ветви" в третьем
слое оказались одинаковы, например, оба С, то надо
было бы сравнивать атомы того же III слоя, но уже в
младшей ветви. Тогда подучил бы преимущество
левый заместитель. Однако, мы не достигаем
этого пункта в наших сравнениях, так как можем
сделать выбор уже на основании различия атомов Ш
слоя старшей ветви.
Совершенно аналогично выбор порядка
старшинства осуществляется, например, между
такими заместителями:
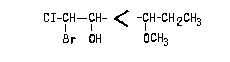
Пример 2.
Может встретиться ситуация, когда для выбора
старшего заместителя необходимо "пройди"
через кратную связь. В таком случае прибегают к
помощи так называемых фантомных атомов,
имеющих нулевой атомный номер (то есть априорно
самых младших) и валентность, равную 1.
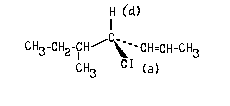
В этом примере примере надр сделать
выбор между левым и правим углеродсодержащими
заместителями. Рассмотрим их, предварительно
"раскрыв" двойную С=С связь первого заместителя.
При этом появятся дублированнве атомы (выделены кружками). К дубликатам атомов присоединим
фантомные атосмы (обозначим их буквой ф) так, чтобы довести валентность каждого до 4:
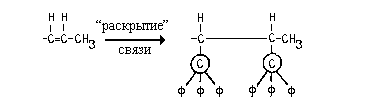
Теперь мы можем провести сравнение левого и
правого заместителей:
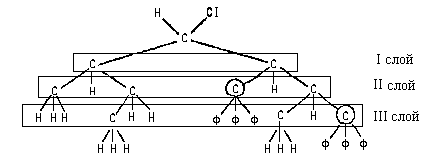
Различие в третьем слое атомов позволяет
отдать предпочтение в старшинстве правому
заместителю:
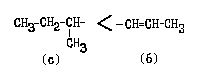
Следовательно, соединение имеет R-конфигурацию.
Пример 3. В ряде случаев два заместителя
при асимметрическом атоме структурно одинаковы,
но различаются лишь абсолютной конфигурацией
хиральных центров. Тогда принимают, что-R-конфигурация
старше S-конфигурации. В соответствии с этим,
центральному атому углерода в приведенном ниже
примере следует приписать S-конфигурацию:
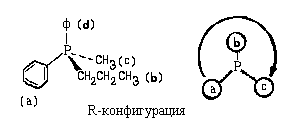
Пример 4. Изложенные выше принципы
применимы также для описания
абсолютной конфигурации асимметрических атомов
с тремя заместителями (атомы азота, фосфора,
серы). При этом в качестве четвертого заместителя
используют фантомный атом, который всегда
является самым младшим ( в роли фантомного атома
можно рассматривать неподеленную пapy
электронов):
Пример 5. Иногда для выбора старшинства
заместителей приходится "раскрывать" цикл,
подобно тому, как производят "раскрытие"
кратной связи.
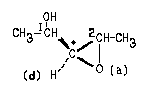
В данном случае легко определить самый
старший (О) и самый младший (Н) заместители при
атоме углерода, отмеченном звездочкой. Для того,
чтобы сделать выбор между атомами углерода 1Си
2С, следует "раскрыть" цикл по связи 2С-
О согласно следующей схеме (дубликаты атомов
выделены кружками):
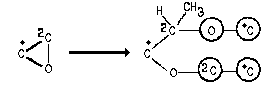
В этом случае, в отличие от "раскрытия"
кратных связей, дублированные атомы уже не
представляют собой "тупиковые" ветви, а
находят продолжение в повторении атома,
отмеченного звездочкой. То есть, процедура
"раскрытия" цикла заканчивается тогда,
когда на концах обеих ветвей оказывается один и
тот же атом (вернее, его дубликат). Теперь мы можем
сравнить атомы 1Си 2С, рассмотрев
соответствующие слои атомов:
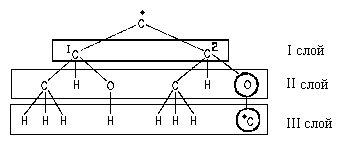
Различие в третьем слое позволяет отдать
преимущество в старшинстве - атому
углерода 2С. Следовательно,
рассматриваемый центр хиралъноети имеет
S-конфигурацию:
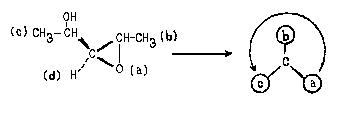
Рекомендуемая литература:
1.Э.Илиел, Основы стереохимии. М.: Мир, 1971, 107 с,
2.В.М.Потапов, Стереохимия. М.: Химия, 1988, 463 с.
3.В.И.Соколов, Введение в теоретическую стереохимию, М., Наука, 1979, 243 с.
|