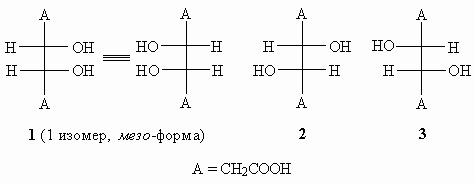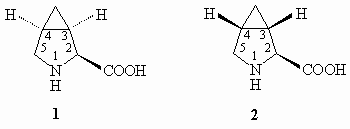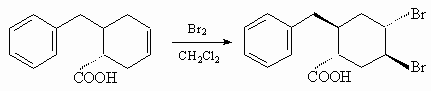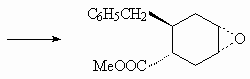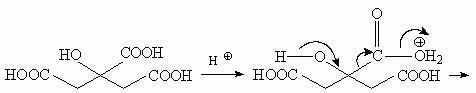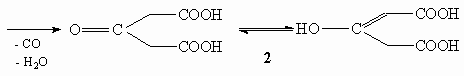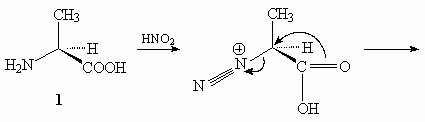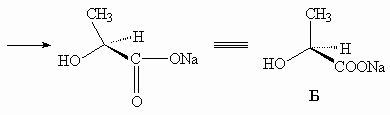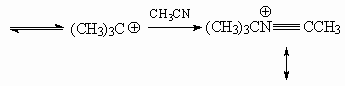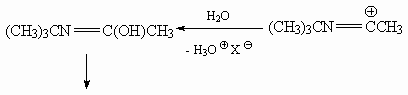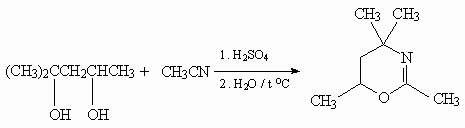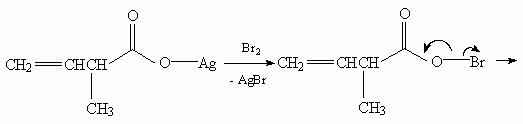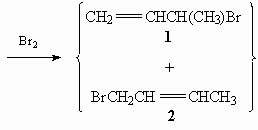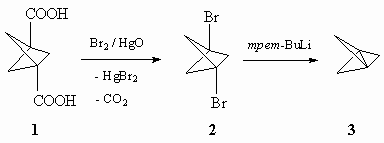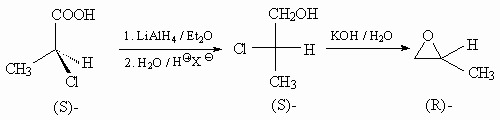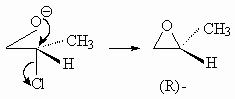|
Учебные материалы/ Органическая химия / Карбоновые кислоты и их производные
ОТВЕТЫ НА КОНТРОЛЬНУЮ РАБОТУ N2
1. 3-метоксибутановая кислота,
трифтороэтановая кислота, трифтороуксусная
кислота,
ацетоксициклопропан, циклопропилэтаноат,
циклопропилацетат,
Z-октадец-9-еновая кислота,
7-метоксигептановая кислота,
октадека-9,12,15-триеновая кислота,
N-метилпропанамид,
кубанкарбоновая кислота,
1,3-дикарбокси-2,4-бис(диметиламино)циклобута-1,3-диен,
3-метил-3-метоксикарбонилциклопропен,
метил 3-метилциклопропен-3-карбоксилат,
метиловый эфир 3-метилциклопропен-3-карбоновой кислоты,
1-цианобицикло[1,1,0]бутан,
1-карбокситрицикло[3,3,1,1]декан,
адамантан-1-карбоновая кислота,
эндо-бицикло[2.2.1]гептан-2-карбоновая кислота,
эндо-норборнан-2-карбоновая кислота,
2-эндо-дейтеробицикло[2.2.1]гептан-2-карбоновая
кислота,
2-эндо-дейтеронорборнан-2-карбоновая
кислота,
2. Кулоновское взаимодействие между ионами СН3СОО-
и Н+ слабее, чем в паре СН3СН2О-
и Н+ из-за сопряжения, описываемого схемой:
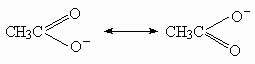
При этом каждый из атомов кислорода
карбоксильной группы несет лишь 1/2 заряда
карбоксилатной группы:
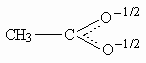
4.
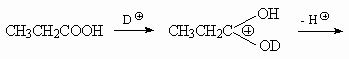
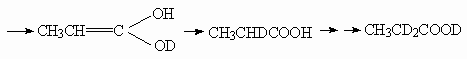
7.
7.1.
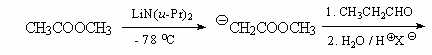
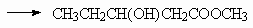
7.2.
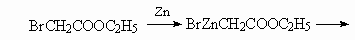
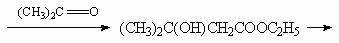
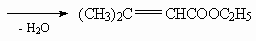
8.Эфир - (СН3)2СНСООСН3, алкен - (СН3)2С=С[СН(СН3)2].
9.
9.1.
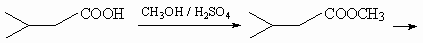
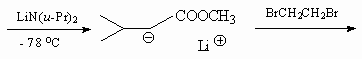

9.2.
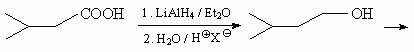
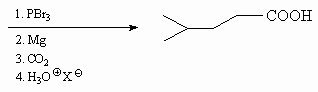
9.3.

9.4.

10.
10.1.
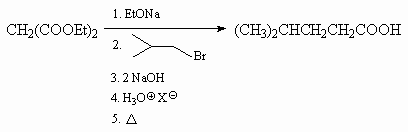
10.2.
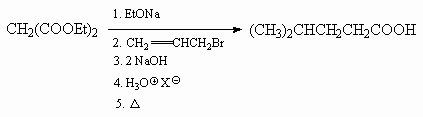
10.3. 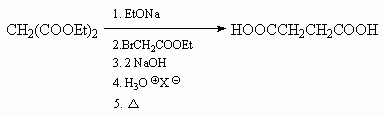
10.4. 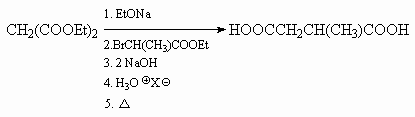
10.5. 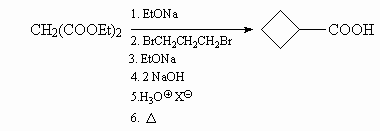
11.
11.1.
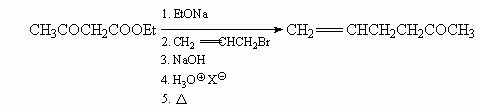
11.2. Через стадию диэтилового эфира
a,b-диацетилянтарной кислоты.
11.3.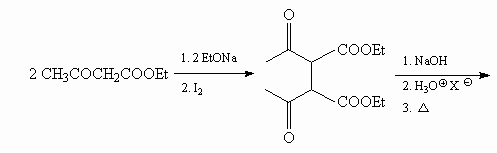 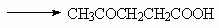
11.4.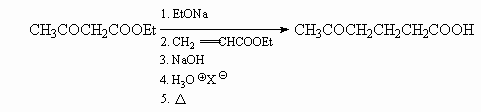
12.
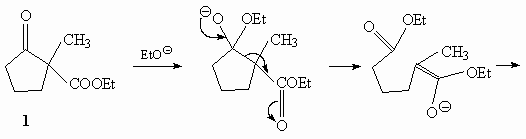
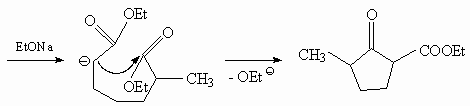
13. 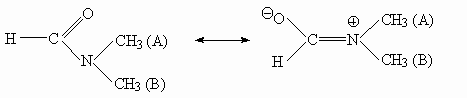
14. 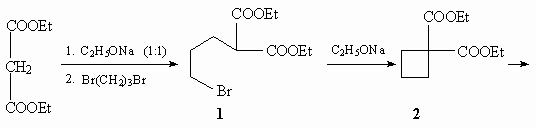
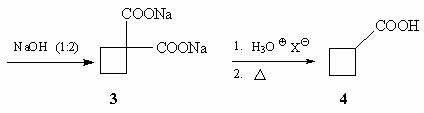
15.
15.1.
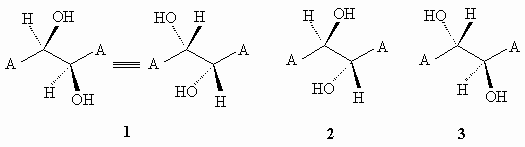 или или
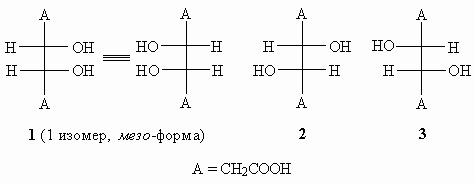
2 и 3 - энантиомеры;1 и 2 - диастереомеры 1 и 3 - диастереомеры
2 изомера (энантиомеры),
15.3. 2 изомера (энантиомеры),
15.4. 2 изомера (энантиомеры),
15.5. 4 изомера (энантио- и диастереомеры),
15.6. 2 изомера (энантиомеры),
15.7. 4 изомера (энантио- и диастереомеры),
15.16. 4 изомера (энантио- и диастереомеры),
15.17. 4 изомера (энантио- и диастереомеры),
15.18. 4 изомера (энантио- и диастереомеры),
15.19. 26 = 64 изомера (энантио- и диастереомеры),
15.24. 2 изомера (энантиомеры),
15.26. 2 изомера (стереоизомерымеры),
15.27. 214 изомеров (энантио- и диастереомеры).
18. Стабильность ионов, образующихся при
диссоциации
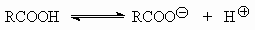
определяется тем, насколько прочно они
сольватированы. В связи с этим очевидно, что
разветвленные заместители, расположенные рядом
с карбоксильной группой, затрудняют сольватацию
возникающего карбоксилат-аниона. Это
обстоятельство, в свою очередь, препятствует
появлению в растворе свободных ионов RCOO- и H+,
поскольку кулоновское взаимодействие
удерживает их в недиссоциированной форме.
19.Для соединения 1 [это природный
(2S,3R,4S)-3,4-метанопролин] возможно существование
эпимера по С(2). В то же время для С(3) и С(4) возможна
лишь еще одна структура с 3S- и 4R-конфигурацией (см.
формулу 2 ). По геометрическим причинам
сочетание 3R,4R и 3S, 4S-центров запрещено. Убедитесь
в этом, рассмотрев молекулярные модели.
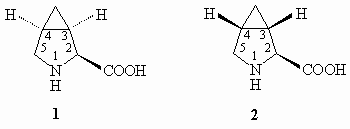
20.
20.1.
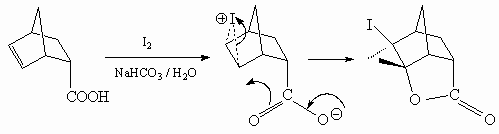
20.2. 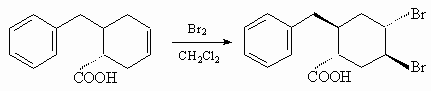
20.3.
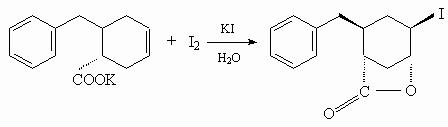
21.
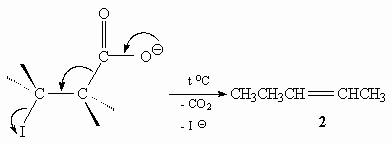
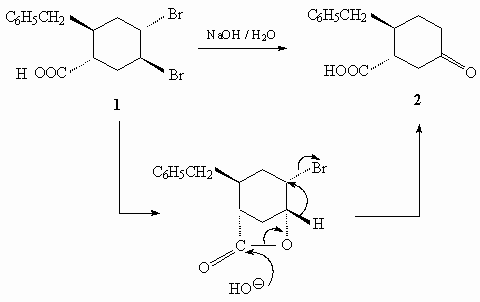
22. 
23.
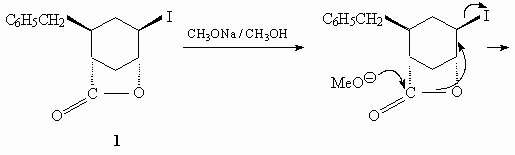
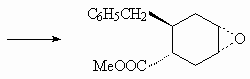
24. 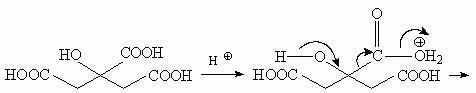
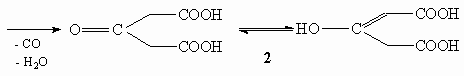
25. 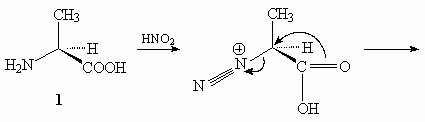
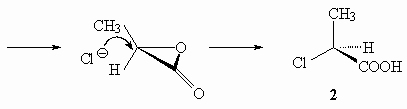
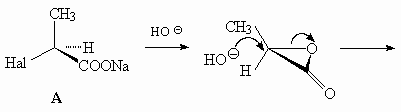
26. 
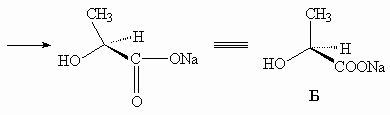
29. Бициклическая структура хинуклидона
предопределяет отсутствие сопряжения между ? N и
С=О группами (р-электроны азота не перекрываются
с  -электронами карбонильной
группы). -электронами карбонильной
группы).
30. Реакция Риттера-Графа.
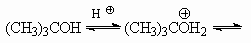
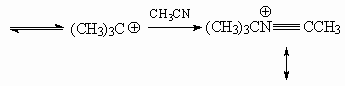
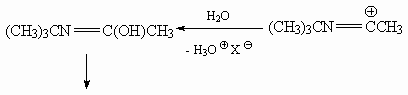
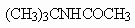
31. Синтез Тильманса-Риттера.
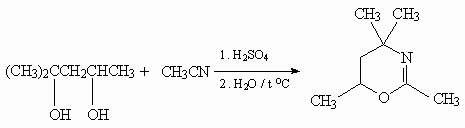
32.
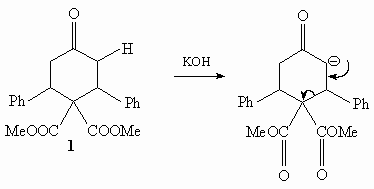
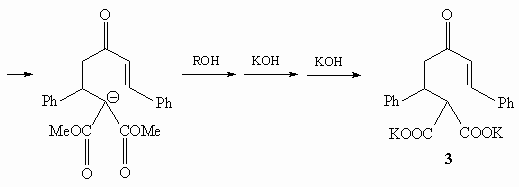
Депротонирование С-Н фрагмента, соединенного с
карбонильной группой, проходит быстрее, чем
гидролиз СООМе групп.
34.
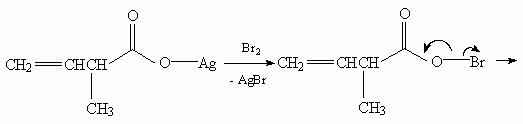
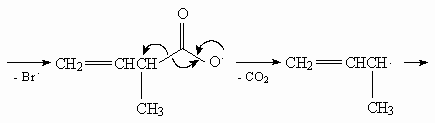
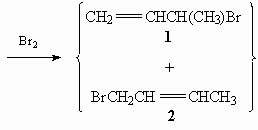
35.
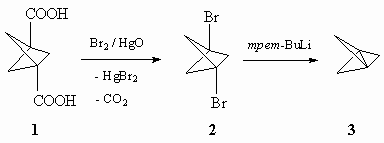
36. (СН3)2СНС=N.
37. (СН3)2С(Br)СOOC2Н5.
38.
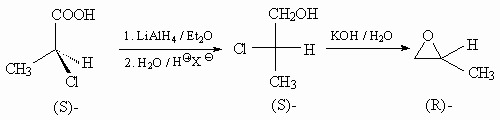
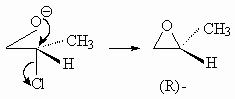
|

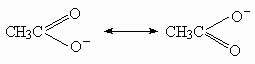

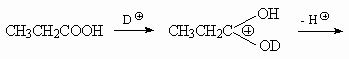
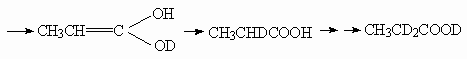
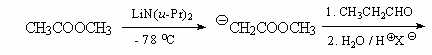
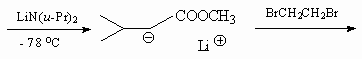

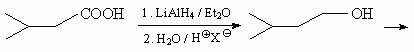

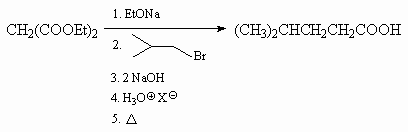
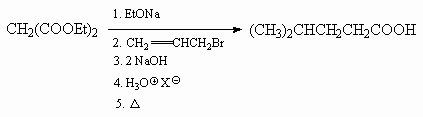
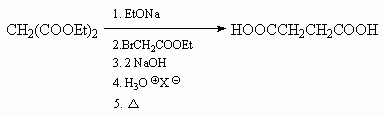
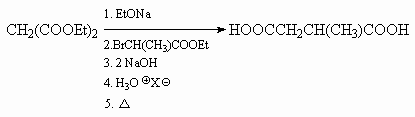
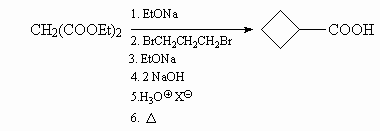
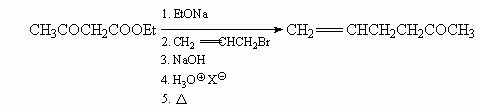

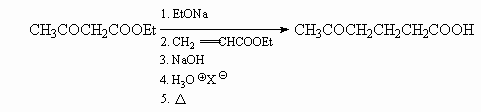

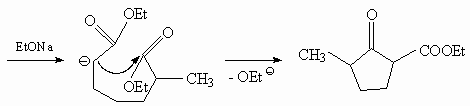
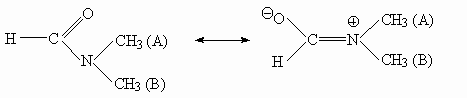
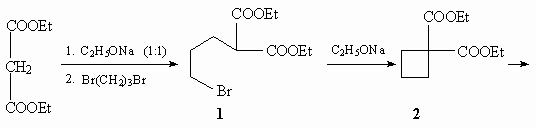
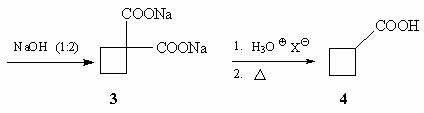
 или
или