|
Бутин К.П. Теоретическая стереохимия/ Органическая химия
8.6.1. Энантиотопные и диастереотопные
атомы, группы и поверхности
Сначала дадим ряд новых определений.
Идентичными группами называются фрагменты
молекул, имеющие одинаковый состав, строение и
конфигурацию. Идентичные группы могут
занимать одинаковые или разные положения.
Например, в молекуле 1,3,6,8-тетранитрофлуорена (XLVI)
идентичны все четыре нитрогруппы, но одинаковые
положения занимают попарно группы в положениях
1,8 и 3,6.
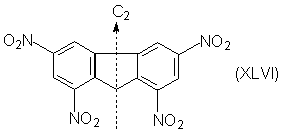
Группы, занимающие одинаковые положения
называются эквивалентными или гомотопными
(от греч. t o p o z - место); они переводятся одна в
другую при повороте молекулы вокруг ее оси
вращения Cn (конечно, n N 1 и n N Ґ ). В соединении
XLVI Cn = C2; ниже приведены другие
примеры гомотопных групп:
Метильные группы в изопропилхлориде не
гомотопны, так как молекула не имеет оси вращения
порядка выше единицы:
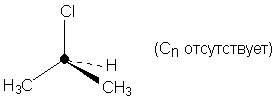
Чтобы проверить, являются ли атомы или группы
эквивалентными, их мысленно заменяют на
какие-нибудь другие атомы или группы. Если в
результате замены новые молекулы будут
идентичны, значит - в исходных молекулах атомы
были эквивалентны. Например, в дифторметане
атомы Н1 и Н2 гомотопны, поскольку при
замене Н1 или Н2 на любую группу Z
получаются идентичные молекулы.
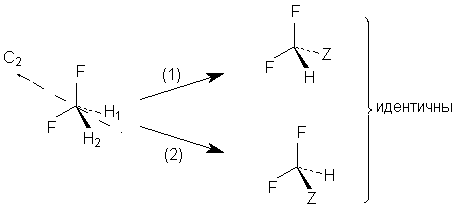
Наоборот, при замене разных атомов водорода СН2-группы
в этаноле на группу Z получаются разные
энантомеры.
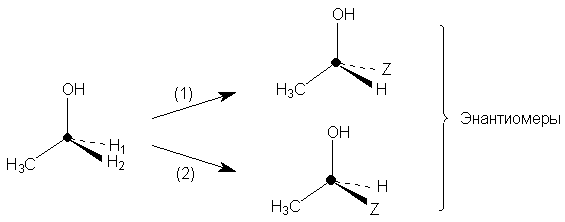
Следовательно, атомы Н1 и Н2 не
гомотопны. Такие атомы или группы, дающие при
замещении третьей группой энантиомеры
называются энантиотопными.
С точки зрения симметрии энантиотопными
называются группы, которые переводятся одна в
другую путем отражения в зеркальной плоскости
или (реже) при операции симметрии Sn
(зеркально-поворотная ось). Поскольку s є S1
(табл.8.2.), энантиотопные группы могут
присутствовать только в ахиральных молекулах
(ср. определение хиральности, данное в разделе
8.2.2.б.):
Ниже приведены примеры соединений, содержащих
энантиотопные атомы водорода, которые условно
обозначены символами НS и НR (т.е.
"левый" и "правый").
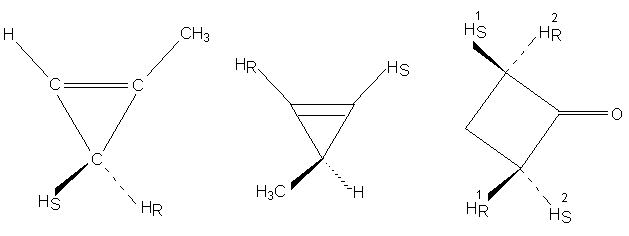
Энантиотопные группы нельзя отличить друг от
друга в ахиральных условиях. Не поможет ни
применение физических методов (ИК,
ЯМР-спектроскопия), ни проведение химической
реакции с ахиральным реагентом. И только в
условиях, обеспечивающих появление различия
между правыми и левыми молекулами, энантиотопные
группы становятся различимыми. Для этого нужно
создать возможность взаимодействия субстрата,
имеющего энантиотопные группы с какой-либо
хиральной, обязательно нерацемической частицей,
например, с нерацемическим хиральным реагентом
или нерацемическим хиральным катализатором.
Например, метиленовые группы, входящие в состав
лимонной кислоты (XLVII) энантиотопны. Если в одну
из них ввести изотопную метку, а затем провести
ферментативное превращение в 2-кетоглутаровую
кислоту (XLVIII), то оказывается, что из двух
имевшихся в исходной молекуле метиленовых групп
окисляется только та, которая не содержала
дейтериевой метки.
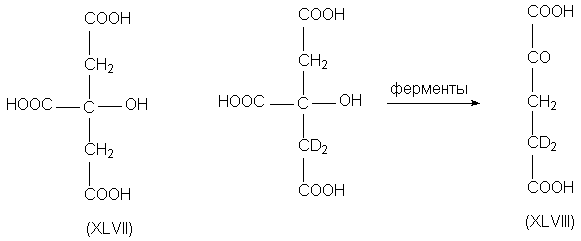
Эта реакция исключительно важна в биохимии; она
входит в метаболический цикл лимонной кислоты,
или цикл Кребса. Причина избирательности
окисления метиленовых групп состоит в том, что
энантиотопные группы в хиральном окружении
становятся диастереотопными.
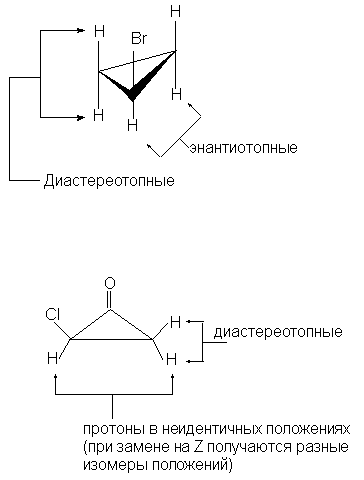
Диастереотопными называются атомы или группы,
расположенные в молекуле таким образом, что
последовательная замена каждой из них группой Z
приводит к получению диастереомеров (или Z- и
E-изомеров в случае алкенов).
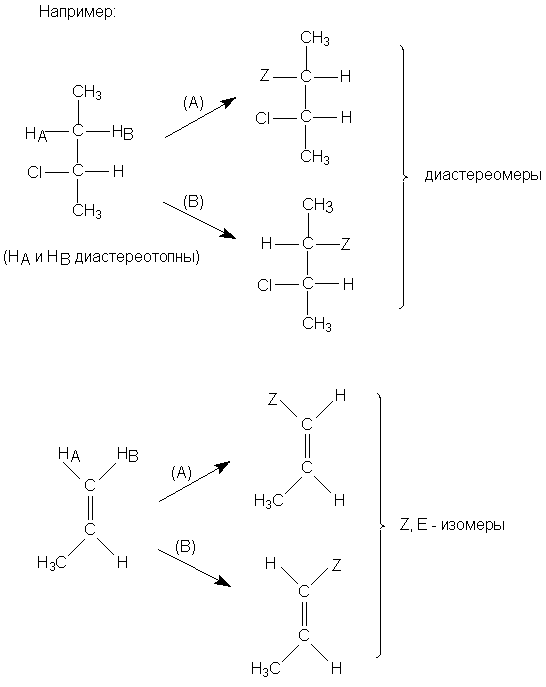
Диастереотопные группы не связаны между собой
никакими элементами симметрии. Ниже приведены
примеры соединений, содержащих диастереотопные
протоны:
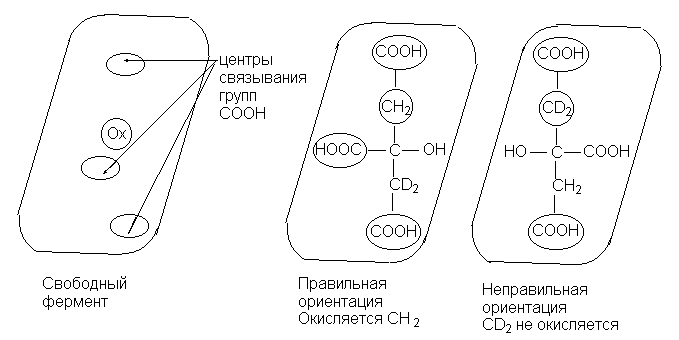
При ферментативном окислении лимонной кислоты
поверхность фермента, взаимодействующего с
субстратом, создает хиральное окружение
субстрата и уничтожает элементы симметрии,
бывшие в свободной молекуле субстрата. Комплекс
субстрат-фермент становится диастереотопным.
При этом активный центр, обозначенный символом
Ох отвечает за окисление при условии, что
молекула субстрата предварительно была
правильно ориентирована при ее иммобилизации на
поверхности фермента. Правильная ориентация
возможна лишь в том случае, если между
поверхностью фермента и молекулой лимонной
кислоты, содержащей энантиотопные группы,
осуществляется "трехточечный контакт"
тремя группами СООН. Это поясняется следующей
схемой:
Диастереотопные группы с ахиральными
реагентами взаимодействуют с разными
скоростями. Другой важной особенностью является
различие в спектрах ЯМР, в которых
диастереотопные протоны должны давать разные
сигналы, расщепленные за счет спин-спинового
взаимодействия друг с другом. Это резко отличает
их от энантиотопных атомов водорода, которые
неразличимы в ЯМР-спектрах за исключением тех
случаев, когда используются хиральные
растворители. Однако, на практике сигналы
диастереотопных протонов часто бывают
неразличимы, т.к. эти сигналы очень близко
расположены друг к другу. Чтобы добиться их
разрешения, применяют лантанидные сдвигающие
реагенты, изменяют концентрацию или подбирают
растворитель.
Отметим, что в соединениях типа X2CYZ группы
X энантиотопны, если и Y, и Z ахиральны, но
диастереотопны, если Y или Z хиральны.
Пусть группа Z хиральна, например, Z = Сabc, где а, b
и с - разные заместители. Тогда могут
существовать три ротамера, А,Б и В, в которых
ближайшее окружение идентичных групп XА и XВ
неодинаково:
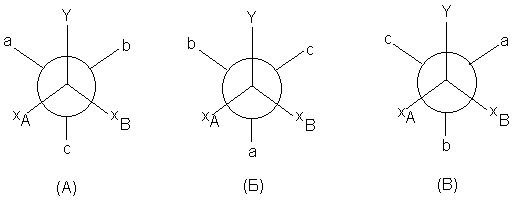
В ротамере А группа XА сближена с а и с, а
группа XВ - с группами b и с. В ротамере Б XА
сближена с а и b, а XВ - с а и с. В ротамере В к
группе XА ближе группы b и с, а к группе XВ
- группы а и b. Таким образом, в каждом ротамере
группы XА и XВ неэквивалентны. Более
того, можно показать, что при всех возможных
переходах между ротамерами А, Б и В, т.е. в
процессе внутреннего вращения, никогда не может
быть конформации, в которой XА имеет точно
такое же окружение как XВ. Даже в условиях
быстрого внутреннего вращения, когда происходит
усреднение индивидуального структурного
окружения отдельно групп XА и XВ во
времени, истинного усреднения при сравнении этих
групп между собой в данный момент времени
происходить не может. В этом наглядно
проявляется истинная неэквивалентность
диастереотопных групп.
По аналогии с энантиотопными или
диастереотопными атомами и группами в
тригональных молекулах различают энантиотопные
или диастереотопные поверхности. Рассмотрим
молекулы формальдегида или ацетона. Атака
ахиральным реагентом А- по карбонильному
углероду приводит к одному и тому же продукту.
Таким образом две поверхности (две стороны
плоскости карбонильной группы) эквивалентны
(гомотопны).
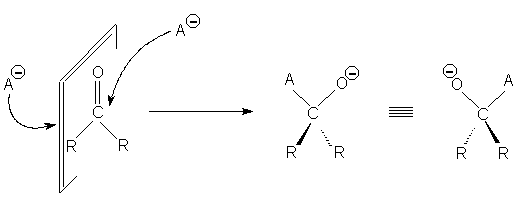
В бутаноне или ацетальдегиде атака ахиральным
реагентом с одной стороны поверхности приводит к
переходному состоянию и продукту, которые
являются энантиомерами переходного состояния и
продукта, образующегося при атаке с другой
стороны поверхности исходной молекулы:
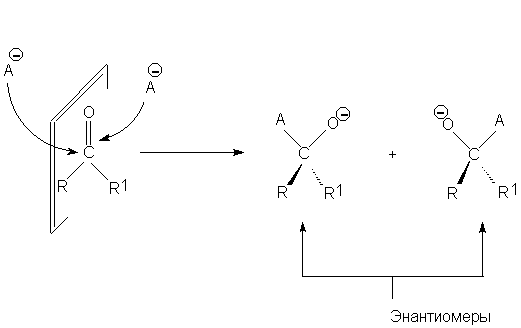
Такие поверхности называют знантиотопными.
Поскольку в том случае, если исходные вещества и
среда оптически неактивны, создать оптически
активный продукт невозможно, в рассматриваемом
случае образуется рацемическая смесь
энантиомеров. Однако при атаке энантиотопной
поверхности хиральным оптически активным
реагентом образуются диастереомеры, и при этом
не в равных количествах.
Две энантиомерные поверхности молекулы
связаны между собой операцией симметрии -
отражением зеркальной плоскости. Если же две
поверхности нельзя связать никакими операциями
симметрии (кроме идентичности), то такие
поверхности называются диастереотопными.
Например, в кетоне XLIX две поверхности
диастереотопны, и в результате взаимодействия
образуются диастереомеры.
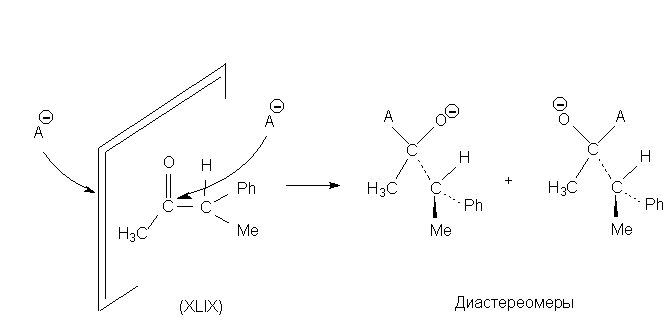
Любые диастереотопные молекулярные
поверхности взаимодействуют дифференцировано с
любым типом реагентов, поскольку реагент,
подходя к разным сторонам поверхности,
испытывает разное влияние.
8.6.2. Синтезы на основе карбонильных
соединений
Один из наиболее распространенных путей
асимметрического синтеза заключается в
образовании хиральных спиртов путем
присоединения по карбонильной группе. Для
осуществления асимметрического синтеза с
прохиральными энантиотопными карбонильными
соединениями проводят реакцию с хиральным
реагентом, хиральным катализатором или в
хиральной среде. В случае диастереотопных
карбонильных групп хиральный реагент,
катализатор или растворитель не требуется,
поскольку необходимый для отличия Правого от
Левого элемент хиральности уже содержится в
исходной молекуле. Асимметрический синтез с
гомотопными карбонильными соединениями
(формальдегидом, ацетоном, бензофеноном и т.п.)
провести невозможно по принципиальным причинам,
связанным с их высокой симметрией.
Обычно для асимметрического синтеза спиртов из
карбонильных соединений используют реакцию
восстановления карбонильной группы
комплексными гидридами алюминия или гидридами
бора или реакцию присоединения
металлоорганических соединений к группе С=0.
8.6.2.а. Асимметрическое восстановление
карбонильной группы
Карбонильные соединения с энантиотопными
сторонами вводят в реакцию с оптически активными
реагентами. Чаще всего используют гидридное
восстановление оптически активными гидридами
алюминия и бора. Хиральные гидриды получают из
различных оптически активных молекул,
содержащих группы, способные координироваться с
бором или алюминием с образованием
конформационно жестких комплексов. Например,
2,2-дигидрокси-1,1-динафтил (XLIX) молекулы которого
обладают аксиальной хиральностью, может быть
разделен на энантиомеры, из которых получают
оптически активные комплексные гидриды
алюминия:
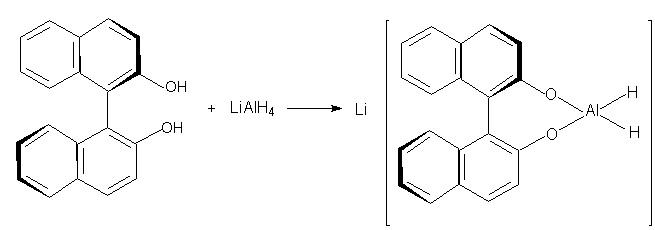
XLIX
Для получения хиральных гидридов помимо
соединений XLIX применяют множество других
хиральных лигандов; ниже приведены некоторые
примеры:
Оптически активный гидрид алюминия, реагируя с
энантиотопным карбонильным соединением,
способен "различать" две разные стороны
плоскости карбонильной группы. Причинами,
обуславливающими такое "хиральное
распознавание" разных сторон молекулы,
являются пространственные и электронные
взаимодействия (хотя пространственные
взаимодействия по-существу - это тоже
электронные взаимодействия, заключающиеся в
отталкивании заполненных оболочек сближенных в
пространстве групп. В качестве примера реакции, в
которой действуют "электронные факторы",
рассмотрим реакцию восстановления карбонильной
группы a ,b -ненасыщенных кетонов комплексным
гидридом алюминия L , который носит название BINAL-H.
Эта реакция в высокой степени энантиоселективна:
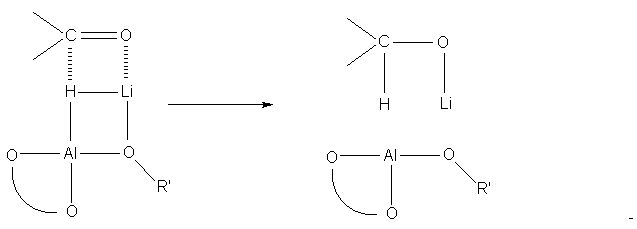
Предполагается, что BINAL-H реагирует в форме LI, в
которой имеется литиевый мостик между
кислородом группы ORў (Rў = Alk) и гидридным
водородом. Механизм восстановления можно
представить следующей схемой:
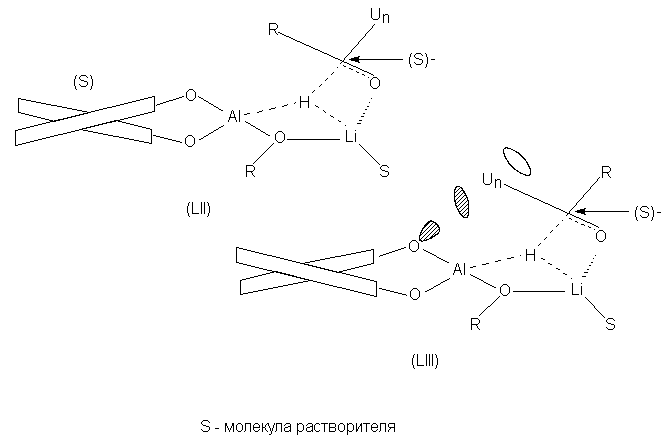
Согласно этой схеме, реакция осуществляется
через циклическое переходное состояние, в
котором литий играет важную роль: координируясь
по атому кислорода карбонильной группы, он
способствует переходу гидридного атома водорода
к атому углерода. Рассматривая структуры
координационных комплексов, например, (S)- BINAL-H с
кетоном (LII и LIII), можно придти к выводу, что
структура LII, приводящая к образованию (S)-спирта
более выгодна, поскольку в структуре LIII имеется
неблагоприятное отталкивание между
неподеленной парой одного из атомов кислорода и p
-электронами ненасыщенной группы.
Таким образом, в этом примере причиной
энантиоселективности является - n,p
-взаимодействие (отталкивание), возможное при
сближении атома кислорода с ненасыщенной
группой. Хотя при увеличении объема группы R
пространственное отталкивание между нею и
нафтольным кислородом в структуре LII
увеличивается, взаимодействие неподеленной пары
с p -системой все же остается более сильным и
поэтому даже для объемистых R указанная
энантиоселективность сохраняется, правда,
энантиомерный избыток в этом случае меньше.
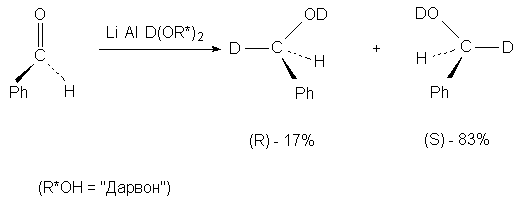
В качестве другого примера асимметрического
синтеза можно привести восстановление
энантиотопного бензальдегида комплексным
дейтеридом алюминия:
Хорошие результаты получены при использовании
в качестве восстановителя
В-3-пинанил-9-борабицикло[3.3.1]нонана, обычно
называемым пинанил-ВВN. С помощью этого реагента
асимметрическое восстановление этинилкетонов, а
также эфиров a -оксокислот удается провести с
энантиомерным избытком 80-100%.
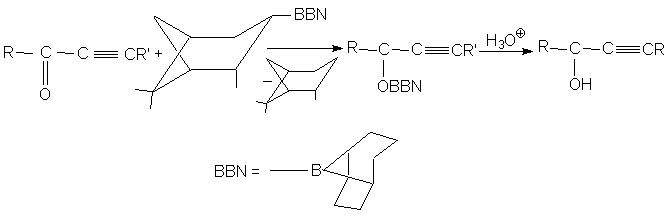
Различие между разными сторонами молекулы
сильно выражено в конформационно жесткой
молекуле 4-трет-бутилциклогексанона, в
которой трет-бутильная группа всегда
занимает экваториальное положение. В этом случае
подход объемистых реагентов со стороны,
занимаемой трет-бутильной группой затруднен,
и поэтому образуется термодинамиически менее
устойчивый аксиальный цис-спирт.
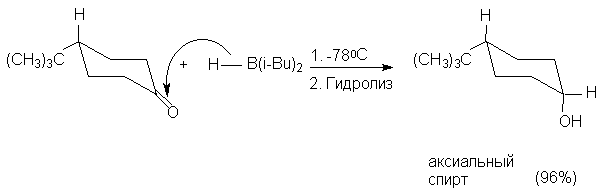
При уменьшении размеров реагента образуется
экваториальный транс-спирт.
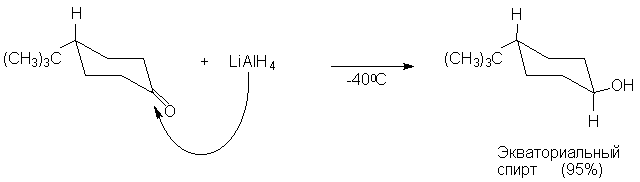
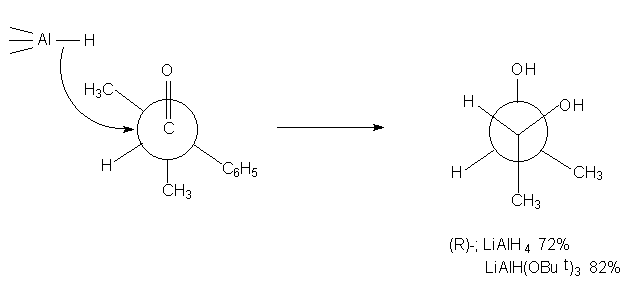
Из этого примера видно, что пространственные
препятствия подходу реагента к карбонильной
группе имеют исключительно важное значение. В
обычных случаях стереоселективность возрастает
с увеличением размеров реагента, например:
Асимметрическое восстановление карбонильной
группы можно осуществить также с помощью
дигидропиридиновых соединениий. Эти реакции
аналогичны ферментативным процессам,
осуществляемым в живых организмах под действием
ферментов, содержащих восстановленную форму
никотинамидадениндинуклеотида (NADH), активным
центром которых является дигидроникотиновый
фрагмент, а роль хирального распознающего
фрагмента - белковая цепь. В синтетическом
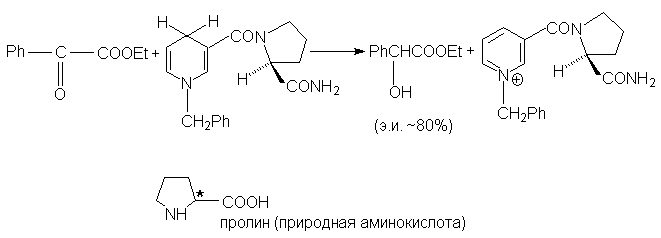
дигидропиридине (LIV) белок заменен на остаток
оптически активной кислоты - пролина. Поскольку
при образовании хирального реакционного
комплекса вовсе небезразлично, каким образом
субстрат и реагент LIV расположатся друг против
друга, возникает разница в энергиях
диастереомерных переходных состояний, которая
достаточно велика и обеспечивает энатиомерный
избыток около 80%:
8.6.2.б. Асимметрическое алкилирование
карбонильной группы
Очень важной проблемой органического синтеза
является энантиоселективное алкилирование
альдегидов металлоорганическими соединениями.
Реакцию можно осуществить с помощью литий-,
магний-, цинк-, алюминий- и борорганических
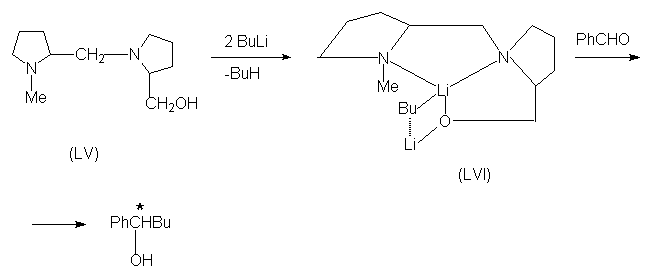
соединений. Например, при взаимодействии
вспомогательного хирального реагента LV с двумя
молями бутиллития образуется конформационно
жесткий комплекс LVI, который в реакции с
бензальдегидом дает оптически активный
1-фенил-пентанол.
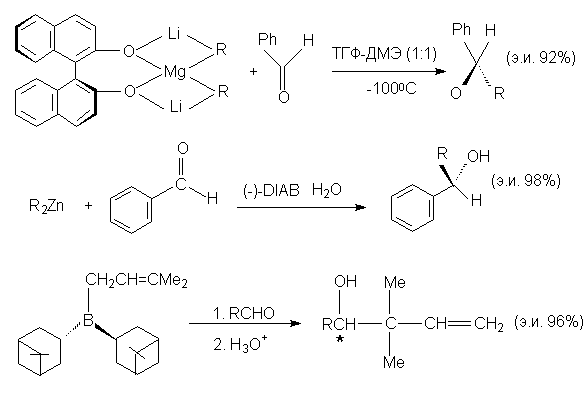
 Ниже приведены
другие примеры асимметрического присоединения
металлоорганических соединений к энантиотопным
альдегидам. Ниже приведены
другие примеры асимметрического присоединения
металлоорганических соединений к энантиотопным
альдегидам.
Для реакций диастереотопных альдегидов и
кетонов асимметрический синтез будет называться
диастереоселективным, по аналогии с
энантиоселективным синтезом в случае
энантиотопных молекул. Диастереоселективность
можно установить с помощью правила Крама и
правила Прелога (см. также гл.16).
Правило Крама предсказывает преимущественную
конфигурацию диастереомеров в тех случаях, когда
асимметрический центр в молекуле исходного
кетона непосредственно связан с карбонильной
группой. В продукте реакции, спирте, будет уже два
хиральных центра - ранее существовавший в
исходном карбонильном соединении и вновь
возникающий из карбонильной группы.
Диастереоселективность зависит от размеров
заместителей, связанных с асимметрическим
центром в исходном субстрате, а также от
предпочтительной конформации данного
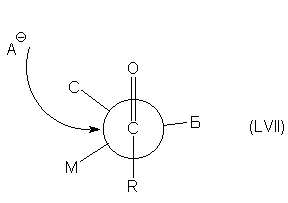
карбонильного субстрата. Можно полагать, что
обычные карбонильные соединения
преимущественно существуют в конформации,
изображенной формулой LVII, в которой символами Б,С
и М обозначены соответственно большой, средний и
малый заместители (по относительным размерам).
Очевидно, что атака реагентом должна
осуществляться преимущественно с той стороны
карбонильной группы, которая пространственно
менее затруднена (на схеме указано стрелкой).
Это правило подтверждается многочисленными
примерами:
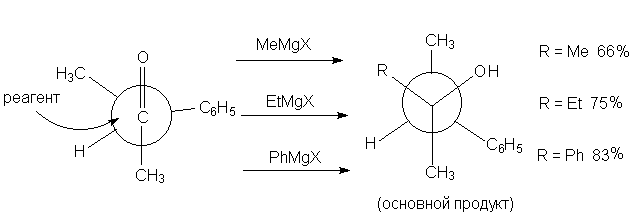 Подобные процессы
получили название асимметрической индукции.
Видно, что при увеличении размеров
магнийорганического соединения
диастереоселективность возрастает. Подобные процессы
получили название асимметрической индукции.
Видно, что при увеличении размеров
магнийорганического соединения
диастереоселективность возрастает.
Правило Крама применимо не только к
алкилированию, но и гидридному восстановлению
карбонильной группы.
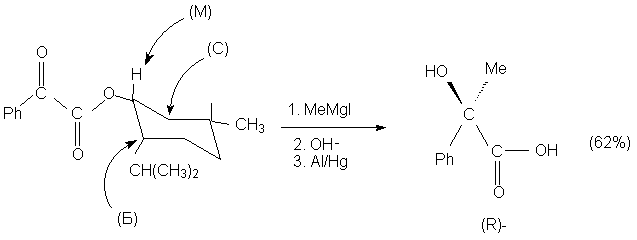
Правило Прелога аналогично правилу Крама, но
только по-своему предсказывает предпочтительную
ориентацию реагента в переходном состоянии. Это
правило используется, например, для предсказания
стереоселективности присоединения реактивов
Гриньяра к оптически активным эфирам a
-оксокарбоновых кислот. Предполагается, что в
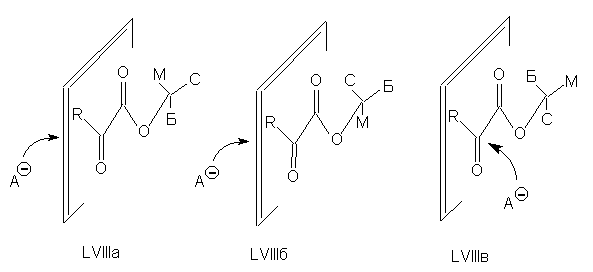
результате свободного вращения существуют три
конформера эфира a - кислоты: LVIIIа-в. По
пространственным причинам конформеры LVIIIа и LVIIIб
должны атаковаться реагентом слева от плоскости,
в которой расположены С=О группы, а конформер LVIIIв
- справа от этой плоскости. Если считать, что все
три конформера в их смеси содержатся в равных
количествах, то предпочтительной будет атака
слева от плоскости.
Подтверждением правила Прелога является,
например, следующая реакция:
|


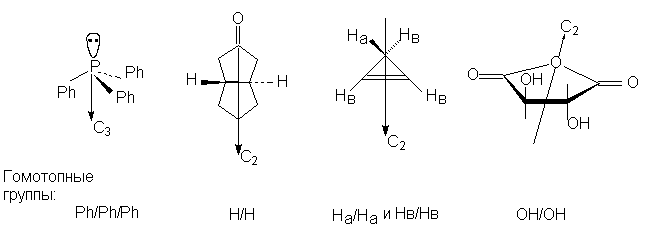
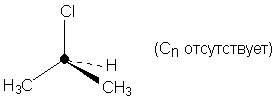












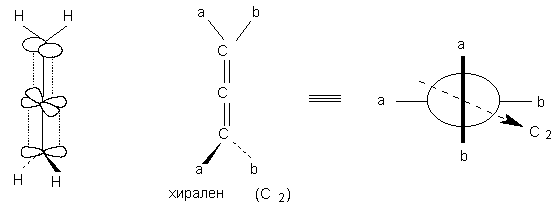





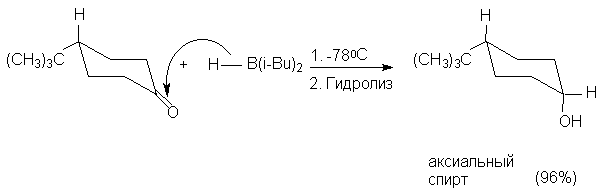



 Ниже приведены
другие примеры асимметрического присоединения
металлоорганических соединений к энантиотопным
альдегидам.
Ниже приведены
другие примеры асимметрического присоединения
металлоорганических соединений к энантиотопным
альдегидам.

 Подобные процессы
получили название асимметрической индукции.
Видно, что при увеличении размеров
магнийорганического соединения
диастереоселективность возрастает.
Подобные процессы
получили название асимметрической индукции.
Видно, что при увеличении размеров
магнийорганического соединения
диастереоселективность возрастает. 
