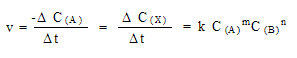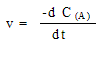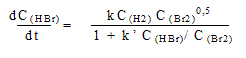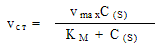|
В.В.Загорский
Трудные темы школьного
курса химии
Элементы химической термодинамики и кинетики
Урок 3 (8)
Химическая кинетика
Предсказания химической термодинамики
наиболее верны в своей “запрещающей” части.
Если, например, для реакции:
N 2 + O2 = 2 NO
изобарно-изотермический потенциал положителен:
 G o = +176 кДж, G o = +176 кДж,
то эта реакция не пойдет самопроизвольно, и
никакой катализатор ей не поможет. Известный
заводской процесс получения NO из воздуха требует
огромных затрат энергии и неравновесного
проведения процесса (“закалка” продуктов
быстрым охлаждением после пропускания смеси
газов через электрическую дугу) [ ]. ].
С другой стороны, далеко не все реакции, для
которых  G < 0, “спешат” осуществиться
на практике. Куски каменного угля могут веками
лежать на воздухе, хотя для реакции G < 0, “спешат” осуществиться
на практике. Куски каменного угля могут веками
лежать на воздухе, хотя для реакции
| C + O2 = CO2 |
 G o = -395 кДж G o = -395 кДж |
Предсказание скорости химической
реакции, а также выяснение зависимости этой
скорости от условий проведения реакции
осуществляет
| химическая кинетика – наука о
химическом процессе, его механизме и
закономерностях протекания во времени. |
Скорость химической реакции определяется
как изменение концентрации C одного из
участвующих в реакции веществ (исходное вещество
или продукт реакции) в единицу времени.
Для реакции в общем виде aA + bB  xX + yY
xX + yY
скорость описывается кинетическим
уравнением :
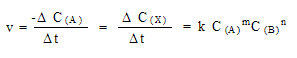
Строго говоря, скорость определяется не как
конечная разность концентраций, а как их
производная:
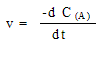
степенные показатели m и n обычно
не совпадают со стехиометрическими
коэффициентами.
Порядком реакции называется сумма
всех показателей степеней m и n .
Порядок реакции по реагенту A равен m .
Число молекул реагентов, участвующих в простой
одностадийной реакции , состоящей из одного
элементарного акта (ее часто называют элементарной
реакцией), называется молекулярностью
реакции .
| Мономолекулярная реакция: |
C2 H6 = 2CH3 . |
| Бимолекулярная реакция: |
CH3 . + CH3 . = C2H6
|
| Примеры относительно редких
тримолекулярных реакций: |
2 NO + O2 = 2 NO2
2 NO + Cl2 = 2 NOCl
H. + H . + Ar = H2 + Ar |
Большинство реакций являются многостадийными,
даже если они описываются относительно простыми
стехиометрическими [ 1]
уравнениями. Нередко для многостадийных реакций
получается сложное суммарное кинетическое
уравнение.
Например, для реакции H2 + Br2 = 2 HBr
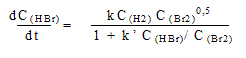
Такая сложная зависимость скорости от
концентраций говорит о многостадийном механизме
реакции.
До сих пор во многих учебниках приводится так
называемый закон действующих масс , который
называют основным законом химической кинетики [ ] [ ] [ ]. В 1867 г., когда этот закон
сформулировали норвежские ученые математик Като
Максимилиан Гульдберг (1836-1902) и химик Петер Вааге
(1833-1900), концентрации они называли “действующими
массами”. ]. В 1867 г., когда этот закон
сформулировали норвежские ученые математик Като
Максимилиан Гульдберг (1836-1902) и химик Петер Вааге
(1833-1900), концентрации они называли “действующими
массами”.
Согласно закону действующих масс, скорость для
реакции, записанной в общем виде:
aA + bB  xX + yY , xX + yY ,
должна выражаться кинетическим уравнением:
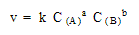
В данном виде закон действителен только для
элементарных реакций, и суммарный порядок не
должен превышать 3 (a + b  3) 3)
Многие ферментативные реакции протекают через
стадию образования между субстратом (реагентом,
вступающим в реакцию) S и ферментом
(катализатором) E промежуточного
фермент-субстратного комплекса SE, который затем
распадается с регенерацией фермента E и
образованием продукта P:
S + E  SE SE
SE  E + P E + P
Для таких реакций в 1913 г. выведено кинетическое
уравнение (уравнение Михаэлиса-Ментен [ ]) для стационарной скорости [ 2]: ]) для стационарной скорости [ 2]:
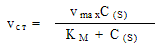
K M – константа Михаэлиса [ ] ]
Типичной сложной многостадийной реакцией
является взаимодействие водорода с кислородом.
Это пример цепного разветвленного процесса, к
которым относится и взрыв ядерной бомбы.
За исследование этого типа реакций в 1956 г.
Н.Н.Семенов [ ] и англичанин Сирил Хиншельвуд [ ] и англичанин Сирил Хиншельвуд [ ] получили Нобелевскую премию. ] получили Нобелевскую премию.
Последовательность процессов при горении
водорода в кислороде [ 3]:

Знание механизмов подобных реакций важно для
создания мощных реактивных двигателей на основе
жидких водорода [ ] и кислорода. ] и кислорода.
21 июля 1969 г. первый землянин – Н.Армстронг
прошелся по Луне. Доставившая его
ракета-носитель “Сатурн-5” состояла из 3
ступеней. В первой использованы керосин и жидкий
кислород, во второй и третьей – жидкие водород и
кислород [ ]. Всего
в ракете было 468 т жидких O2 и H2 . ]. Всего
в ракете было 468 т жидких O2 и H2 .
С апреля 1981 г. в США осуществляет полеты “Спейс
шаттл”. Космические челноки поднимаются на
орбиту за счет горения 713 т жидких O2 и H2 , а также
двух твердотопливных ускорителей по 590 т каждый
(суммарная масса твердого топлива 987 т). Первые 40
км подъем осуществляется на твердотопливных
ускорителях, от 40 до 113 км используются водород и
кислород.
15 мая 1987 г. состоялся первый старт советской
ракеты “Энергия”, 15 ноября 1988 г. первый и
единственный полет возвращаемого “Бурана”.
Стартовая масса 2400 т., масса топлива (керосина в
боковых отсеках, жидких O2 и H2 ) 2000 т. Мощность
двигателей 125000 МВт, полезный груз 105 т [ 4] [ ]. ].
Опубликовано
1. Стехиометрическое
уравнение реакции составлено в соответствии с
мольными соотношениями веществ, вступающих в
реакцию, по нему можно вычислить и массовое
соотношение реагентов и продуктов. Т.е. это
привычное нам “уравнение реакции”. Термин
“стехиометрия” (от греч. “стойхеон” -
“основание”, “элемент” и “метрео” -
“измеряю”) ввел немецкий химик Иеремия Вениамин
Рихтер (1762-1807) в 1793 г. .
2. Леонор Михаэлис (1875-1949) –
немецкий биохимик.
3. Панченков Г.М., Лебедев В.П.
Химическая кинетика и катализ. 2-е изд. – М.: Химия,
1974. – 592 с., с.273
4. Губанов Б.
“Энергия”-”Буран” – шаг в будущее Наука и
жизнь, 1989, № 4, с.2-9;
Патрунов Ф.Г. Ниже 120 о по Кельвину. – М.: Знание, 1989.– 176 с., с.97-99
|