|
В.В.Загорский
Трудные темы
школьного курса химии
Химическая связь и строение молекул
Урок 3
Понятие о неэмпирических квантовых
расчетах
Приближенные методы валентных
связей (ВС) и молекулярных орбиталей (МО)
В современных химических исследованиях
благодаря распространению мощных ЭВМ широко
применяются неэмпирические квантовые
расчеты, в которых из экспериментальных
данных используются только заряды ядер атомов.
В неэмпирической квантовой химии практически
исчезло упоминание о типе гибридизации или
порядках связей (т.е. на схемах не рисуют
двойные и тройные связи, а только указывают
их силовые характеристики) [ 1]. Не используются и
условные классификации (ионная, ковалентная,
донорно-акцепторная, металлическая связь).
Фактически расчеты сводятся к нахождению
распределения электронной плотности (она
показывает, «где электрон бывает чаще»)
в поле нескольких ядер.
При расчетах не удается записать математические
уравнения непосредственно для электронной
плотности, и приходится определять не имеющую
непосредственного физического смысла волновую
функцию Y, квадрат
модуля (абсолютной величины) которой и равен
электронной плотности [ 2]. Функцию Y
определяют, решая уравнение Шредингера, связывающего
энергию электронов E и оператор энергии (гамильтониан)
H. Последний описывает число частиц, их массы,
заряды, законы взаимодействия и внешние поля.
Уравнение Шредингера, как и основные законы
термодинамики, не выводится из общих физических
принципов; к нему можно прийти при помощи
ряда правил, но это – не дедуктивный
вывод из ранее известных законов.
Как решение уравнения Шредингера HY = EY
отыскивается волновая функция Y.
Ее физический смысл в том, что ее квадрат
Y2
определяет плотность вероятности нахождения
частицы в соответствующем месте пространства
и позволяет рассчитать ее динамические характеристики
(«жесткость» связи, частоту колебаний).
Решение даже простейшего уравнения Шредингера
для атома водорода [ ] требует математической
подготовки [ ] требует математической
подготовки [ ]. ].
Поскольку даже для системы из трех частиц
не существует точного решения, приходится
в случае расчетов сложных атомов и молекул
вводить упрощающие предположения (приближения
), т.е. рассматривать модельные
системы .
В физическом смысле нет разницы между
атомом и молекулой. Стабильность атома гелия
и молекулы водорода обусловлены общими причинами.
Тем не менее, объединение в стабильную "
многочастичную " систему с несколькими
атомными ядрами принято называть химической
связью.
Полный гамильтониан многочастичной системы
включает три вклада:
Нполн. = Нэя +
Нвнеш. + Нвнут.
Нэя – кинетические
и электростатические взаимодействия;
Нвнеш. – взаимодействия
с внешними электрическими и магнитными полями;
Нвнут. – спиновые взаимодействия
электронов и ядер.
Обычно используют приближения двух типов:
первые упрощают выражение для Н полн., вторые
упрощают расчетные интегралы (частные случаи
конкретных методов).
Первое приближение при
расчетах (обычно его даже не считают приближением)
– в нем рассматриваются изолированные
системы – атомы, молекулы без окружения.
Второе приближение .
Почти во всех расчетных методах пренебрегают
неэлектростатическими взаимодействиями Н
внеш. и Н внут.. Расчет спин-спиновой и спин-орбитальной
энергии важен в основном для магниторезонансной
спектроскопии.
Третье приближение .
Если учитывать электростатическое взаимодействие
в па'рах электронов, нельзя получить точное
решение дифференциального уравнения. Поэтому
предполагают, что каждый электрон самостоятельно
движется в электростатическом поле
ядер и в усредненном по пространству и времени
потенциале остальных электронов. Волновые
функции, которые являются решением при этих
приближениях, называются атомными или молекулярными
орбиталями (АО или МО).
При этом многоэлектронная функция должна
удовлетворять принципу Паули (в системе нет
двух электронов с одинаковыми одноэлектронными
функциями).
Известно, что большинство стабильных молекул
имеют четное число электронов и равный нулю
полный спин. Это значит, что электроны занимают
одинаковое число спиновых состояний А и В.
Тогда многоэлектронную функцию описывают
набором двухэлектронных функций со всеми
одинаковыми состояниями, кроме спиновых.
Такая наиболее устойчивая система называется
системой с замкнутой оболочкой.
В таком третьем приближении химическую
связь рассматривают в рамках методов валентных
связей и молекулярных орбиталей
.
Метод ВС (валентных
связей) [  ]. ].
Ковалентная связь описывается функциями
"локального синглетного " [ 3] состояния
– предполагается, что все связи образованы
независимыми электронными парами с суммарным
нулевым спином у каждой. В расчетах по методу
ВС пренебрегают интегралами перекрывания
(взаимодействием электронных пар), и тогда
важнейшим условием связи становится образование
электронной пары с антипараллельными спинами.
Волновая функция должна удовлетворять возникновению
"локальных синглетных " состояний
в областях связей.
Получаются качественно правильные результаты,
но количественно МО лучше соответствуют эксперименту.
Традиционно в этом методе активно используют
гибридизацию орбиталей (см. предыдущий
урок) [  ]. Гибридизация улучшает результаты, так
как можно выбрать ориентацию атомной орбитали
вдоль связи.
]. Гибридизация улучшает результаты, так
как можно выбрать ориентацию атомной орбитали
вдоль связи.
Кроме гибридизации, в методе широко используются
понятия σ - и p-связей.
При этом изображаемые в подавляющем большинстве
учебников картинки, например, «связей
в молекуле азота» [  ], весьма далеки
от рассчитанного более точными методами распределения
электронной плотности: ], весьма далеки
от рассчитанного более точными методами распределения
электронной плотности:
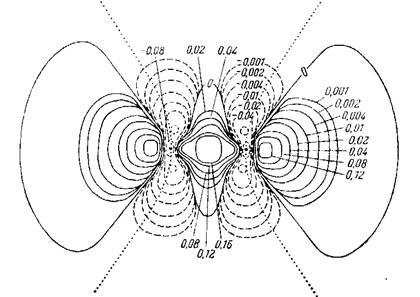
Диаграмма распределения
электронной плотности для молекулы N2
(расчет по Хартри-Фоку [ ], 1967 г.) [
4] ], 1967 г.) [
4]
Метод МО ЛКАО (молекулярные
орбитали - линейная комбинация атомных орбиталей).
Если предположить , что
а) электрон "ощущает"
потенциал ядра лишь вблизи этого ядра;
б) электрон может быть
описан модификациями функций – решений
задачи для атома водорода,
то можно построить систему одноэлектронных
функций – молекулярных
орбиталей . Дополнительно предполагают
, что основную роль играют орбитали
наименее связанных электронов атомов –
валентные орбитали. Теоретическое обоснование
таких предположений затруднительно, но модель
наглядна.
При использовании водородоподобных орбиталей
нужно помнить:
а) При графическом изображении угловых
частей атомных орбиталей (шары и гантели)
указывается область математического пространства,
в которой с заданной вероятностью
(чаще 0,9) находится электрон. Заряд электрона
не "размазан" в этой области!
б) При изображении АО обязательно указывают
знак волновой функции (+ или -) в отдельных
частях АО. Знак важен для расчетов, но не
имеет физического смысла.
в) Для удобства расчетов часто используют
одноэлектронные функции, простирающиеся на
всю молекулу. Для построения таких молекулярных
орбиталей используют не сами атомные орбитали,
а их линейные комбинации – гибридные
орбитали .
г) В рамках рассмотрения гибридных МО
важное значение имеет интеграл перекрывания
между АО. АО должны обладать одинаковой симметрией
по отношению к вращениям и отражениям и иметь
близкие энергии. В таких терминах очень хорошо
описываются соединения элементов 2-го периода.
Диаграммы МО (молекулярных
орбиталей)
Обычно в учебниках приводится готовая
схема (схемы) с не очень понятными объяснениями,
поскольку диаграммы являются результатом
достаточно сложных расчетов. При построении
МО в приближении ЛКАО исходят не из готовых
атомов, а из готового ядерного остова (например,
из двух ядер атомов Н) и затем выясняют,
в каких возможных состояниях может находиться
один электрон в потенциальном поле
двухъядерного остова [ 5].
Затем это возможные молекулярные состояния
(молекулярные орбитали) постепенно
заполняют электронами в правильной энергетической
последовательности (снизу вверх) и с учетом
принципа Паули строят систему возможных (двухатомных)
молекул, подобно тому, как в том же одноэлектронном
приближении строили периодическую систему.
Исходной моделью здесь служит молекулярный
ион Н 2 +, который играет такую же роль,
как и атом Н при построении атомных состояний.
Если по результатам расчетов электронная
плотность между ядрами данной молекулярной
орбитали повышена (>0), то орбиталь называют
связывающей. Если электронная плотность между
ядрами равна нулю, то орбиталь называют разрыхляющей
или антисвязывающей. Энергия связывающей
МО ниже исходных АО, разрыхляющей МО - выше
исходных АО [  (разделы 3.3.1-3.3.4)]. (разделы 3.3.1-3.3.4)].
Общие правила построения диаграмм изложены
в учебниках Н.С.Ахметова [ 6] и Л.С.Гузея [ 7].
Здравый смысл . Электростатически
стабильно состояние, когда электроны находятся
между двумя ядрами. При этом спиновая функция
по принципу Паули должна быть антисимметричной.
Популярно о применении методов квантовой
механики в молекулярном конструировании и
молекулярной динамике можно прочитать в журнале
КОМПЬЮТЕРРА №8 (483), 11 марта 2003 г.
[  ]. ].
Вещества, трудные для теоретиков:
комплексные соединения,
соединения с сопряженными
связями, бороводороды
Комплексные (координационные)
соединения
При рассмотрении с точки зрения простейшего
деления химических связей на ионные и ковалентные
многие особенности комплексных соединений
кажутся необъяснимыми – например, легкий
обмен в ряде комплексов заряженных лигандов
Cl - и нейтральных лигандов H2O:
[Cu(H2O)2Cl2
] + 2 H2O  [Cu(H2O)
4 ] 2+ + 2Cl - [Cu(H2O)
4 ] 2+ + 2Cl -
Теории строения комплексных соединений
подробно рассмотрены в учебнике, размещенном
на сайте alhimik.ru [  ]. ].
Компактно и наглядно строение комплексных
соединений описано в электронном учебнике
«Открытая химия 2.5» [  (глава 9)]. (глава 9)].
Сопряженные связи и теория резонанса
Молеклу этилена можно вполне удовлетворительно
описать, рассматривая ее как два углеродных
тетраэдра с общим ребром (см. иллюстрацию
из книги Л.Полинга в предыдущем уроке [ http://www.chem.msu.su/rus/teaching/Zagorskii/4/welcome.html
]. Однако если две двойных связи находятся
в молекуле рядом, разделенные одинарной связью,
то характеристики двойной и одинарной связи
как бы усредняются, что делает возможными
типичные для диенов реакции 1,4-присоединения
[  ]. Предельное
«усреднение» происходит в ароматических
углеводородах – молекула бензола может
быть представлена как равновесная между двумя
крайними структурами. Еще Кекуле [ ]. Предельное
«усреднение» происходит в ароматических
углеводородах – молекула бензола может
быть представлена как равновесная между двумя
крайними структурами. Еще Кекуле [  ] предположил,
что двойные связи в 1,3,5-циклогексатриене
непрерывно перемещаются, и оба изомера быстро
превращаются друг в друга (теория "осцилляции
валентности") [ ] предположил,
что двойные связи в 1,3,5-циклогексатриене
непрерывно перемещаются, и оба изомера быстро
превращаются друг в друга (теория "осцилляции
валентности") [  ]: ]:
В 1928 г Л.Полинг предложил термин «резонанс»
[ ]
для описания подобных структур. ]
для описания подобных структур.
А летом 1951 г. в Москве прошло Всесоюзное
совещание по теории строения в органической
химии, больше известное как совещание по
борьбе с теорией резонанса [ ].
В истории российской советской науки это
была единственная серьезная попытка политизировать
химию. К чести химиков можно сказать, что
у них здравый научный смысл победил и большинство
ученых не последовали за «борцами с
буржуазным идеализмом», как это произошло,
к сожалению, в отечественной биологии [ ].
В истории российской советской науки это
была единственная серьезная попытка политизировать
химию. К чести химиков можно сказать, что
у них здравый научный смысл победил и большинство
ученых не последовали за «борцами с
буржуазным идеализмом», как это произошло,
к сожалению, в отечественной биологии [ ]. ].
Строение бороводородов
Соединения бора с водородом (бораны) рассматривали
в качестве перспективного ракетного топлива
из-за высокой удельной теплоты сгорания (~70
кДж/г), это значительно выше, чем у углеводородов
(45 кДж/г). В результате детальных исследований
оказалось, что строение боранов нельзя описать
в рамках теорий ВС и МО [ 8] [  ]. Даже для простейшего
диборана B 2 H 6 классические представления,
согласно которым два атома связаны одной
парой электронов, были неприемлемы. Для связи
двух «нормальных» молекул BH 3
у бора не хватало электронов. ]. Даже для простейшего
диборана B 2 H 6 классические представления,
согласно которым два атома связаны одной
парой электронов, были неприемлемы. Для связи
двух «нормальных» молекул BH 3
у бора не хватало электронов.
В 1950-е гг. было введено понятие трехцентровых
связей. В них сферическая s -орбиталь
водорода перекрывается одновременно двумя
вытянутыми p -орбиталями двух атомов
бора. Образуется две связи – над и
под мысленной плоскостью, в которой расположены
фрагменты ВН 2.
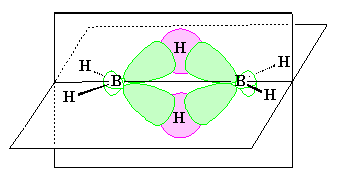
Таким образом, в связь бора с водородом,
лежащую над плоскостью и образованную традиционной
парой электронов, вовлекается еще один атом
бора, который при этом для образования связи
электрона не поставляет. Его электрон участвует
в образовании точно такой же связи под плоскостью.
Поскольку обе связи как бы усреднены (электроны
делокализованы), принято считать, что для
образования одной трехцентровой связи атом
водорода дает один электрон, а каждый атом
бора по 1/2 электрона. В итоге в каждой трехцентровой
связи три атома связаны всего двумя электронами.
Такие системы называют электронодефицитными.
В настоящее время формулу диборана изображают,
используя обычную схему валентных связей:
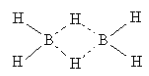
При этом получается – водород как
бы двухвалентный, что выглядит необычно.
Однако химики понимают, что это трехцентровая
связь; потому такое обозначение стало привычным.
Проверь себя
Выберите правильный ответ (или ответы)
Химическая связь
11. Сколько электронов находится условно
на внешнем уровне атома азота
в молекуле NH3 ?
1) 2; 2) 3; 3) 6; 4) 8
12. В молекуле аммиака химическая связь:
1) ковалентная полярная; 2) ковалентная
неполярная; 3) ионная; 4) донорно-акцепторная
13. Кристаллическая решетка графита:
1) ионная; 2) молекулярная; 3) атомная;
4) металлическая
14. В каком списке перечисленные молекулы
расположены по типу связи от наиболее ионной
(слева) до наименее полярной ковалентной
(справа):
1) HBr, NaCl, CsI, BrCl3 ; 2) RaBr 2, SrCl2, HCl; Cl2O;
3) HF, LiBr, KCl, H2О; 4) NaCl, HBr,
BrCl3, CsI
15. Выберите примеры неполярной молекулы,
имеющей полярную ковалентную или ионную связь:
1) азот; 2) вода; 3) метан; 4) дифторид
бериллия
16. Сколько всего электронов содержится
в ионе Ga+3?
17. Укажите валентность и степень окисления
азота в азотной кислоте. Ответ запишите цифрами
без знаков и пробелов.
18. Укажите валентность и степень окисления
углерода в мочевине (NH2)2CO. Ответ запишите
цифрами без знаков и пробелов.
19. Сколько всего электронов содержится
в радикале этиле CH3 CH2. ?
20. Какова валентность алюминия в димере
хлорида алюминия Al2Cl6?
© В.В.Загорский, 1998-2004
ОТВЕТЫ.
Химическая связь
11. 4) 8
12. 1) ковалентная полярная
13. 3) атомная
14. 2) RaBr2, SrCl2, HCl; Cl2O
15. 3) метан; 4) дифторид бериллия
16. 28 (порядковый номер минус положительный
заряд)
17. 45 (валентность 4 максимальная для
элементов 2-го периода)
18. 44
19. 17
20. 4
Опубликовано:
1.
Витковская Н.М., Пупышев В.И. Квантовая химия
В: Современное естествознание: Энциклопедия:
В 10 т. – М.: Флинта: Наука, 1999-2000.
Т.1. Физическая химия – 328 с., с.
6-11
2.
Пупышев В.И. Современные представления о
химической связи В: Современное естествознание:
Энциклопедия: В 10 т. – М.: Флинта:
Наука, 1999-2000. Т.1. Физическая химия –
328 с., с. 32-37
3.
Если суммарный спин электронной пары равен
нулю (спины ориентированы противоположно),
то такое ее состояние называется синглетным,
а если спины направлены параллельно и суммарный
спин равен 1, то такое ее состояние называется
триплетным.
4.
Хабердитцл В. Строение материи и химическая
связь: Пер. с нем. – М.: Мир, 1974.
– 296 с., с. 221
5.
Хабердитцл В. Строение материи и химическая
связь. Пер. с нем. – М.: Мир, 1974.
– 296 с., с. 101-103, 114-116, 168
6.
Ахметов Н.С. Общая и неорганическая химия
– издание 2-е (1988), стр. 52-70
7.
Гузей Л.С., Кузнецов В.Н., Гузей А.С. Общая
химия М, 1999, стр. 67-80, 192-193.
8.
Левицкий М.М., Леменовский Д.А. Выдающиеся
соединения органической химии. Карборан Интернет:

|