|
В.В.Загорский
Трудные темы школьного курса химии
Строение атома и Периодический
закон [ *]
Урок 2
Рассмотренные выше квантовые числа могут
показаться понятиями абстрактными и далекими
от химии. Действительно, пользоваться ими
для расчетов строения реальных атомов и молекул
можно только при наличии специальной математической
подготовки и мощной ЭВМ. Однако, если добавить
к схематично изложенным понятиям квантовой
механики еще один принцип, квантовые числа
"оживают" для химиков.
В 1924 г Вольфганг Паули [ ] сформулировал один из важнейших постулатов
теоретической физики, который не вытекал
из известных законов: на одной орбитали (в
одном энергетическом состоянии) не может
одновременно находиться более двух электронов,
да и то только в том случае, если их спины
противоположно направлены. Другие формулировки:
две тождественные частицы не могут находиться
в одном квантовом состоянии; в одном
атоме не может быть двух электронов с совпадающими
значениями всех четырех квантовых чисел.
] сформулировал один из важнейших постулатов
теоретической физики, который не вытекал
из известных законов: на одной орбитали (в
одном энергетическом состоянии) не может
одновременно находиться более двух электронов,
да и то только в том случае, если их спины
противоположно направлены. Другие формулировки:
две тождественные частицы не могут находиться
в одном квантовом состоянии; в одном
атоме не может быть двух электронов с совпадающими
значениями всех четырех квантовых чисел.
Попробуем "создать" электронные оболочки
атомов, пользуясь последней из формулировок
принципа Паули.
Минимальное значение главного квантового
числа n равно 1. Ему соответствует только
одно значение орбитального числа l , равное
0 (s-орбиталь). Сферическая симметрия s-орбиталей
выражается в том, что при l = 0 в магнитном
поле существует только одна орбиталь с m
l = 0. На этой орбитали может находиться
один электрон с любым значением спина (водород)
или два электрона с противоположными значениями
спинов (гелий). Таким образом, при значении
n = 1 может существовать не более двух электронов.
Теперь начнем заполнять орбитали с n =
2 (на первом уровне уже есть два электрона).
Величине n = 2 соответствуют два значения
орбитального числа: 0(s-орбиталь) и 1 (p-орбиталь).
При l = 0 существует одна орбиталь , при
l = 1 – три орбитали (со значениями
m l : -1, 0, +1). На каждой из орбиталей
может находиться не более двух электронов,
так что значению n = 2 соответствует максимум
8 электронов. Общее число электронов на уровне
с данным n можно вычислить, таким образом,
по формуле 2n2 :
|
n |
2 |
|
l |
0 |
1 |
|
m l |
0 |
-1 |
0 |
+1 |
|
m s |
± 1/2 |
± 1/2 |
± 1/2 |
± 1/2 |
Обозначим каждую орбиталь квадратной ячейкой,
электроны – противоположно направленными
стрелками. Для дальнейшего "строительства"
электронных оболочек атомов необходимо использовать
еще одно правило, сформулированное в 1927
г. Фридрихом Хундом (Гундом): наиболее устойчивы
при данном l состояния с наибольшим суммарным
спином, т.е. количество заполненных орбиталей
на данном подуровне должно быть максимальным
(по одному электрону на орбиталь).
Начало периодической таблицы будет выглядеть
следующим образом:
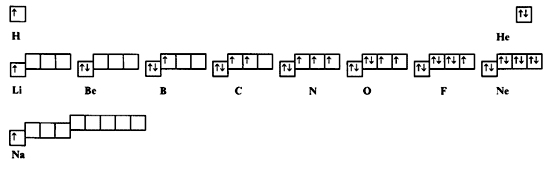
Схема заполнения электронами внешнего
уровня элементов 1-го и 2-го периодов.
Продолжая "строительство", можно дойти
до начала третьего периода, однако затем
придется вводить как постулат порядок заполнения
d и f орбиталей.
Из схемы, построенной на основании минимальных
допущений, видно, что квантовые объекты (атомы
химических элементов) будут по разному относиться
к процессам отдачи и принятия электронов.
Объекты He и Ne будут к этим процессам безразличны
из-за полностью занятой электронной оболочки.
Объект F скорее всего будет активно принимать
недостающий электрон, а объект Li скорее
будет склонен отдать электрон.
Уникальными свойствами должен обладать
объект C – у него одинаковы число орбиталей
и число электронов. Возможно, он будет стремиться
образовывать связи сам с собой благодаря
такой высокой симметрии внешнего уровня.
Интересно отметить, что понятия о четырех
принципах построения материального мира и
пятом, их связывающем, известны не менее
25 веков. В Древней Греции и Древнем Китае
философы говорили о четырех первопринципах
(не путать с физическими объектами): “огонь”,
“воздух”, “вода”,
“земля” [ ]. Связывающим принципом в Китае было “дерево”
[
]. Связывающим принципом в Китае было “дерево”
[  ], в Греции – “квинтэссенция”
(пятая сущность). Взаимосвязь “пятого
элемента” с остальными четырьмя продемонстрирована
в фантастическом фильме с тем же названием.
], в Греции – “квинтэссенция”
(пятая сущность). Взаимосвязь “пятого
элемента” с остальными четырьмя продемонстрирована
в фантастическом фильме с тем же названием.
Игра "Параллельный мир"
Для того, чтобы лучше понять роль "абстрактных"
постулатов в окружающем нас мире, полезно
переместиться в "Параллельный мир". Принцип
простой: структура квантовых чисел немного
искажается, затем на основе их новых значений
строим периодическую систему параллельного
мира. Игра будет удачной в том случае, если
меняется только один параметр, не требующий
дополнительных допущений по взаимосвязи квантовых
чисел и уровней энергии.
Впервые подобная задача-игра была предложена
школьникам на Всесоюзной олимпиаде в 1969
году (9 класс):
"Как бы выглядела периодическая система
элементов, если бы максимальное число электронов
в слое определялось формулой 2n 2 -1, а на
внешнем уровне не могло бы быть больше семи
электронов? Изобразите таблицу такой системы
для четырех первых периодов (обозначив элементы
их атомными номерами). Какие степени окисления
мог бы проявить элемент N 13? Какие свойства
соответствующего простого вещества и соединений
этого элемента вы могли бы предположить?
Такая задача слишком сложна. В ответе
необходимо проанализировать несколько сочетаний
постулатов, устанавливающих значения квантовых
чисел, с постулатами о связи между этими
значениями. При детальном разборе этой задачи
мы пришли к выводу, что искажения в "параллельном
мире" получаются слишком большими, и мы не
можем корректно прогнозировать свойства химических
элементов этого мира.
Мы в СУНЦ МГУ обычно используем более
простую и наглядную задачу, в которой квантовые
числа "параллельного мира" почти не отличаются
от наших. В этом параллельном мире живут
аналоги людей – хомозоиды [ ] (не следует относиться серьезно к описанию
самих хомозоидов).
] (не следует относиться серьезно к описанию
самих хомозоидов).
Периодический закон и строение
атома
Задача 1.
Хомозоиды живут в параллельном мире, имеющем
следующий набор квантовых чисел:
n = 1, 2, 3, 4, ...
l = 0, 1, 2, ... ( n –
1)
ml = 0, +1, +2,...(+ l
)
ms = ± 1/2
Постройте первые три периода Их периодической
таблицы, сохраняя наши названия для элементов
с соответствующими номерами.
1. Чем умываются хомозоиды ?
2. Чем напиваются хомозоиды ?
3. Напишите уравнение реакции между Их
серной кислотой и гидроксидом алюминия.
Анализ решения
Строго говоря, нельзя изменить одно из
квантовых чисел, не затрагивая остальных.
Поэтому все описанное ниже – не истина,
а учебная задача.
Искажение почти незаметно – магнитное
квантовое число становится асимметричным.
Впрочем, это означает существование в параллельном
мире однополюсных магнитов и другие серьезные
последствия. Но вернемся к химии. В случае
s- электронов изменений не происходит ( l
= 0 и m 1 = 0). Следовательно, водород
и гелий там те же самые. Полезно вспомнить,
что по всем данным именно водород и гелий
являются самыми распространенными элементами
во Вселенной. Это позволяет допустить существование
подобных параллельных миров. Однако для p-
электронов картина меняется. При l =
1 мы получаем два значения вместо трех: 0
и +1. Следовательно, имеется только две p-
орбитали , на которых можно разместить 4
электрона. Длина периода уменьшилась. Строим
"клетки-стрелочки":
Построение Периодической таблицы параллельного
мира:
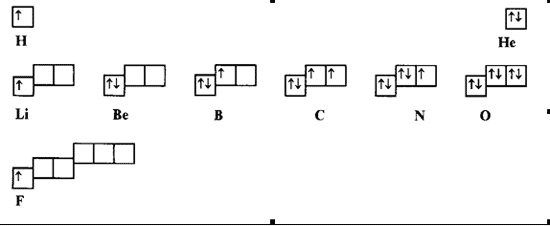
Периоды, естественно, стали короче (в
первом 2 элемента, во втором и третьем –
по 6 вместо 8. Очень весело воспринимаются
изменившиеся роли элементов (названия за
номерами сохраняем специально): инертные
газы O и Si , щелочной металл F. Чтобы не
запутаться, будем обозначать их элементы
только символами, а наши –
словами.
Анализ вопросов задачи позволяет разобрать
значение распределения электронов на внешнем
уровне для химических свойств элемента. Первый
вопрос простой – водород = H, а кислородом
становится C. Все сразу соглашаются, что
без галогенов (N, Al и т.д.) параллельный
мир не обойдется. Ответ на второй вопрос
связан с решением проблемы – почему
у нас углерод является "элементом жизни"
и что будет его параллельным аналогом. В
ходе обсуждения выясняем, что такой элемент
должен давать "наиболее ковалентные" связи
с аналогами кислорода, азота, фосфора, серы.
Приходится немного пойти вперед и разобрать
понятия гибридизации, основного и возбужденного
состояний. Тогда элементом жизни становится
аналог нашего углерода по симметрии ( B )
– у него на трех орбиталях находится
три электрона. Результат такого обсуждения
– аналог этилового спирта BH 2BHCH.
При этом становится очевидным, что в параллельном
мире мы лишились прямых аналогов нашей 3-й
и 5-й (или 2-й и 6-й) групп. Например, элементы
3 периода соответствуют:
|
натрий |
магний |
алюминий |
кремний |
фосфор |
сера |
хлор |
аргон |
|
F |
Ne |
- |
Na |
- |
Mg |
Al |
Si |
Максимальные степени окисления: Na (+3),
Mg (+4), Al (+5); однако приоритетными являются
химические свойства и их периодическое изменение,
к тому же длина периода уменьшилась.
Тогда ответ на третий вопрос (если нет
аналога алюминия):
Серная кислота + гидроксид алюминия =
сульфат алюминия + вода
H 2 MgC3 + Ne(CH)2 = NeMgC3 + 2 H
2 C
Или как вариант (прямого аналога кремния
нет):
H 2 MgC3 + 2 Na(CH)3 = Na2 ( MgC 3
)3 + 6 H2C
Главный результат описанного "путешествия
в параллельный мир" – понимание того,
что бесконечное разнообразие нашего мира
вытекает из не очень большого набора относительно
простых законов. Примером таких законов являются
разобранные постулаты квантовой механики.
Даже небольшое изменение одного из них резко
меняет свойства вещественного мира.
Проверь себя
Выберите правильный ответ (или ответы)
Строение атома, периодический
закон
1. Исключите лишнее понятие:
1) протон; 2) нейтрон; 3) электрон; 4)
ион
2. Число электронов в атоме равно:
1) числу нейтронов; 2) числу протонов;
3) номеру периода; 4) номеру группы;
3. Из перечисленных ниже характеристик
атомов элементов периодически изменяются
по мере роста порядкового номера элемента:
1) число энергетических уровней в атоме;
2) относительная атомная масса;
3) число электронов на внешнем энергетическом
уровне;
4) заряд ядра атома
4. На внешнем уровне атома химического
элемента в основном состоянии находится 5
электронов. Какой это может быть элемент:
1) бор ; 2) азот ; 3) сера ; 4) мышьяк
5. Химический элемент расположен в 4-м
периоде, IА группе. Распределению электронов
в атоме этого элемента соответствует ряд
чисел:
1) 2, 8, 8, 2 ; 2) 2, 8, 18, 1 ; 3) 2,
8, 8, 1 ; 4) 2, 8, 18, 2
6. К р-элементам относится:
1) калий ; 2) натрий ; 3) магний ; 4)
алюминий
7. Могут ли электроны иона K + находиться
на следующих орбиталях ?
1) 3p ; 2) 2f ; 3) 4s ; 4) 4p
8. Выберите формулы частиц (атомы, ионы)
с электронной конфигурацией 1s 2 2s 2 2p
6 :
1) Na + ; 2) K + ; 3) Ne ; 4) F –
9. Сколько элементов было бы в третьем
периоде, если бы спиновое квантовое число
имело единственное значение +1 (остальные
квантовые числа имеют обычные значения)?
1) 4 ; 2) 6 ; 3) 8 ; 4) 18
10. В каком ряду химические элементы расположены
в порядке возрастания их атомного радиуса?
1) Li, Be, B, C ;
2) Be, Mg, Ca, Sr ;
3) N, O, F, Ne ;
4) Na, Mg, Al, Si
© В.В.Загорский , 1998-2004
ОТВЕТЫ
- 4) ион
- 2) числу протонов
- 3) число электронов на внешнем энергетическом
уровне
- 2) азот ; 4) мышьяк
- 3) 2, 8, 8, 1
- 4) алюминий
- 1) 3p ; 3) 4s ; 4) 4p
- 1) Na + ; 3) Ne ; 4) F –
- 1) 4
- 2) Be, Mg, Ca, Sr
* Опубликовано:
- Загорский В.В. Вариант изложения в физико-математической
школе темы “Строение атома и Периодический
закон”, Российский химический журнал
(ЖРХО им. Д.И.Менделеева), 1994, т. 38, N
4, с.37-42
- Загорский В.В. Строение атома и Периодический
закон / "Химия" N 1, 1993 (прил. к газете
"Первое сентября")
|


