Влияние температуры на скорость химической реакции. Дополнительный материал.
Правило Вант-Гоффа
Правило Вант-Гоффа - не более чем правило, оно не имеет силу закона.
Во-первых, Вант-Гофф мог изучать химические реакции в ограниченных условиях,
которые обеспечивала лабораторная техника того времени. Как выяснилось позже, температурный
коэффициент в значительном температурном интервале непостоянен.
Кроме того, из-за несовершенства технических средств невозможно было изучать
как очень быстрые реакции (протекающие за миллисекунды), так и очень медленные (для которых требуются
тысячи лет). Реакции с участием больших молекул сложной формы (например, белков) также не подчиняются
правилу Вант-Гоффа.
Энергия активации
Молекула - энергетически выгодное образование (в противном случае никаких молекул не существовало бы). Это значит,
что химические вещества на энергетической диаграмме занимают положение в "ямках".
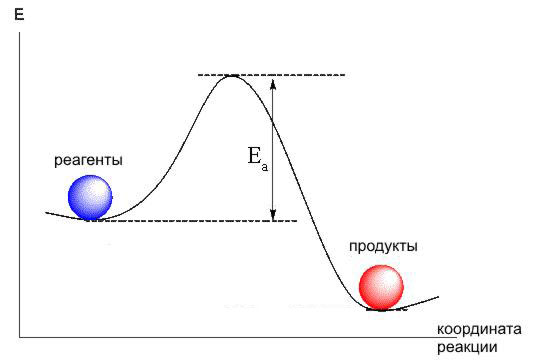
Если мы хотим провести реакцию, т.е. превратить эти вещества в другие, мы должны сообщить реагентам
энергию, достаточную для того, чтобы они выбрались из "ямки", перевалили через окружающий
его "барьер" (энергию активации).
Для этого, как правило, требуется нагреть реакционную смесь до определенной температуры, чтобы
увеличить кинетическую энергию молекул. Если энергетический барьер реакции невысок, для ее начала
бывает достаточно удара или трения.
Приложения
| 






