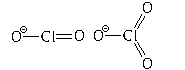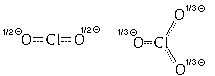С. Т. Жуков Химия 8-9 класс
Глава 13.Важнейшие классы неорганических веществ (2)
13.7. Основания
К основаниям относятся:
а) ионные гидроксиды, соответствующие основным
оксидам (см. § 13.4);
б) некоторые не содержащие гидроксидных ионов
вещества, молекулы которых способны принимать
протон (аммиак NH3, гидразин N2H4 и
некоторые другие соединения).
Частицами-основаниями в этих веществах являются
или гидроксид-ионы (а), или сами молекулы
оснований (б).
Все основания удобно разделить на три группы: I -
растворимые ионные основания (щелочи), II -
нерастворимые (то есть очень мало растворимые)
основания и III - молекулярные основания.
Все растворимые ионные основания (щелочи)
являются сильными основаниями. Из нерастворимых
гидроксидов слабыми являются только те, которые
в той или иной степени проявляют амфотерные
свойства. Все молекулярные основания - слабые.
Основания I группы в воде химически растворяются,
основания II группы также химически растворяются
в воде, но крайне незначительно, а растворение
оснований III группы - отчасти физическое, а
отчасти химическое (часть растворившихся
молекул обратимо реагирует с водой):
.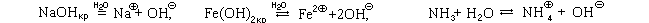
По той или иной причине в растворах
оснований присутствуют гидроксид-ионы, поэтому
растворы оснований I и III группы изменяют окраску
кислотно-основных индикаторов.
Реакции, характеризующие химические свойства
оснований, распадаются на две группы. К первой
относятся КОР, связанные с наличием в составе
оснований частиц, способных принимать протон
(частиц-оснований). Это реакции с веществами,
содержащими частицы-кислоты или амфолиты (см.
рис. 12.1): с сильными кислотами, со слабыми
кислотами (в том числе с катионными) и с кислыми
солями.
1) Все основания реагируют с растворами сильных
кислот, то есть с растворами, содержащими ионы
оксония.
OH + H3O
+ H3O = 2H2O,
Fe(OH)2 + 2H3O
= 2H2O,
Fe(OH)2 + 2H3O = Fe2
= Fe2 + 4H2O, NH3 + H3O
+ 4H2O, NH3 + H3O = NH4
= NH4 + H2O,
+ H2O,
NaOHр + HNO3р = NaNO3р + H2O, Fe(OH)2
+ 2HClр = FeCl2р + 2H2O, NH3 + HClO4р
= NH4ClO4р.
1а) Сильные основания реагируют и со слабыми
кислотами:
OH + HNO2
= H2O + NO2
+ HNO2
= H2O + NO2 , 2OH
, 2OH + H2SiO3 = 2H2O + SiO32
+ H2SiO3 = 2H2O + SiO32 ,
,
KOHp + HNO2p = H2O + KNO2p, 2KOHp +
H2SiO3 = 2H2O + K2SiO3p.
Возможность реакции слабого основания со слабой
кислотой определяется общим правилом,
определяющим направление протекания КОР.
Кислотно-основные реакции между
веществами-основаниями и веществами-кислотами
могут протекать и в отсутствие воды:
KOHкр + H3PO4ж = KH2PO4кр + H2O;
Mg(OH)2кр + 2HClг = MgCl2кр + 2H2O; NH3г
+ HClг = NH4Clкр.
Правда, практическое значение эти реакции имеют
только для оснований III группы, так как в
остальных случаях вода образуется сразу после
начала реакции.
2) Растворимые основания реагируют с растворами
кислых солей, содержащими как анионы-амфолиты,
так и гидросульфат-ион и подобные ему
частицы-кислоты:
OH + HCO3
+ HCO3 = H2O + CO32
= H2O + CO32 , NH3 +
HSO4
, NH3 +
HSO4 = NH4
= NH4 + SO42
+ SO42 ,
,
NaOHр + NaHCO3р = H2O + Na2CO3р;
2NH3 + 2NaHSO4р = Na2SO4p + (NH4)2SO4p.
Гидросульфаты, кроме того, реагируют и с
нерастворимыми основаниями.
3) Растворимые основания реагируют с растворами
солей, в состав которых входят катионные кислоты:
2OH + [Fe(H2O)6]2 + [Fe(H2O)6]2 = [Fe(H2O)4(OH)2] = [Fe(H2O)4(OH)2] + 2H2O, + 2H2O, |
2OH + Fe2 + Fe2 aq = Fe(OH)2aq aq = Fe(OH)2aq |
2NaOHp + FeSO4p = Fe(OH)2 + Na2SO4p + Na2SO4p |
2NH3 + [Mg(H2O)4]2 = [Mg(H2O)2(OH)2] = [Mg(H2O)2(OH)2] + 2NH4 + 2NH4 |
2NH3 + 2H2O + Mg2 aq = Mg(OH)2aq aq = Mg(OH)2aq +
2NH4 +
2NH4 |
2NH3 + 2H2O + MgSO4aq = Mg(OH)2 + (NH4)2SO4p + (NH4)2SO4p |
Упрощенно эти реакции можно
рассматривать как реакции осаждения из
растворов нерастворимых гидроксидов.
Растворы щелочей реагируют с растворами солей, в
состав которых входят катионные кислоты и
другого типа, иными словами, в том случае, когда
при реакции образуется растворимое слабое
основание:
OH + NH4
+ NH4 = H2O + NH3, 2KOH
+ (NH4)2SO4 = K2SO4 + 2NH3
+ 2H2O.
= H2O + NH3, 2KOH
+ (NH4)2SO4 = K2SO4 + 2NH3
+ 2H2O.
В приведенной реакции из
концентрированных растворов или при нагревании
аммиак может выделяться в виде газа. Выделение
аммиака происходит полнее, если
концентрированным раствором щелочи обработать
твердый сульфат аммония.
Ко второй группе реакций относятся реакции, не
являющиеся кислотно-основными и вызванные
стремлением к делокализации заряда. Это реакции
с кислотными и амфотерными оксидами, а также с
амфотерными гидроксидами.
4) Щелочи (и малорастворимые основания) реагируют
с кислотными и амфотерными оксидами, при этом в
реакции могут вступать, как твердые щелочи (или
расплавы)
2KOH + SO3 = K2SO4 + H2O, 2NaOH + Cr2O3
= 2NaCrO2 + H2O (при нагревании),
так и их растворы
2OH + CO2
= CO32
+ CO2
= CO32 + H2O, 2OH
+ H2O, 2OH + ZnO + H2O = [Zn(OH)4]2
+ ZnO + H2O = [Zn(OH)4]2 ,
,
2NaOH + CO2 = Na2CO3 + H2O, 2KOH + ZnO + H2O
= K2[Zn(OH)4].
Диоксид кремния с заметной скоростью реагирует
только с расплавами щелочей:
SiO2кр + 2NaOHж = Na2SiO3 + H2O
(при нагревании).
5) Щелочи реагируют с амфотерными гидроксидами:
2OH +
Zn(OH)2 = [Zn(OH)4]2
+
Zn(OH)2 = [Zn(OH)4]2 , 3OH
, 3OH + Cr(OH)3 = [Cr(OH)6]3
+ Cr(OH)3 = [Cr(OH)6]3 ,
,
2NaOHр + Zn(OH)2 = Na2[Zn(OH)4]р,
3KOHр + Cr(OH)3 = K3[Cr(OH)6]р.
В случае, когда гидроксид гидратирован
(свежеосажденный и не высушенный), эти реакции
относятся к кислотно-основным.
6) Особняком от первых двух групп реакций стоят
реакции, в которых с концентрированными
растворами щелочей реагируют амфотерные металлы
и некоторые неметаллы:
2OH + Be
+ 2H2O = [Be(OH)4]2
+ Be
+ 2H2O = [Be(OH)4]2 +H2
+H2 , 2OH
, 2OH + Cl2 = Cl
+ Cl2 = Cl + ClO
+ ClO + H2O,
+ H2O,
2NaOHк + Be +2H2O = Na2[Be(OH)4]р
+H2 , 2KOHк + Cl2 = KClр + KClOр + H2O.
, 2KOHк + Cl2 = KClр + KClOр + H2O.
7) Все нерастворимые гидроксиды (в том числе и
основания) легко разлагаются при нагревании
(примеры см. в § 2.5).
Растворимые и малорастворимые основания можно
получить при взаимодействии с водой
соответствующих металлов или оксидов, а
нерастворимые - осаждением щелочью из растворов
солей.
 Приведите уравнения реакций, характеризующие
химические свойства а) гидроксида калия,
б) гидроксида магния, в) аммиака.
Приведите уравнения реакций, характеризующие
химические свойства а) гидроксида калия,
б) гидроксида магния, в) аммиака.
2.Составьте схему механизма реакции хлора с
раствором щелочи (см. гл. 11.4)
3.Получите двумя способами а) гидроксид натрия, б)
гидроксид кальция, в) гидроксид лития. 4.Получите
из двух различных веществ а) гидроксид магния, б)
гидроксид марганца(II), в) гидроксид меди(II).
5.Осуществите превращения: NiO  NiSO4
NiSO4  Ni(OH)2
Ni(OH)2  Ni(NO3)2.
Ni(NO3)2.
6.Определите концентрацию гидроксида лития в
растворе, 200 мл которого потребовалось для
осаждения из раствора соли 1, 427 г гидроксида
железа(III).
 Химические свойства оснований.
Химические свойства оснований.
13.8. Кислоты
К кислотам относятся:
а) ковалентные гидроксиды, соответствующие
кислотным оксидам (см. § 13.5) -
кислородсодержащие кислоты;
б) ковалентные гидриды - бескислородные
кислоты.(По традиции "кислотами" называют
водные растворы ковалентных гидридов, например,
раствор хлороводорода называют соляной
(хлороводородной) кислотой, раствор сероводорода
- сероводородной кислотой и т.п. Соответствующие
безводные газообразные соединения
"кислотами" не называют)
Кроме того, кислотами также являются некоторые
ионные вещества, содержащие ионы оксония. Это
устойчивые только при низких температурах "
соли оксония" : (H3O)Cl, (H3O)Br, (H3O)2SO4
и некоторые другие. По химическим свойствам
растворы этих " солей оксония" ничем не
отличаются от растворов соответствующих
молекулярных кислот - соляной, бромоводородной,
серной и т. д.
Большинство кислотных гидроксидов (оксокислот) -
молекулярные вещества. Исключение составляет
нерастворимая в воде кремниевая кислота (ее
состав только упрощенно отражается формулой H2SiO3)
и некоторые другие кислоты.
Растворение кислот в воде - химическое
растворение. При растворении кислоты в воде
протекает КОР, необратимая в случае сильной
кислоты и обратимая в случае слабой:
HNO3 + H2O = H3O + NO3
+ NO3
CH3COOH + H2O 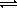 H3O
H3O + CH3COO
+ CH3COO
Способность кислот отдавать протоны определяет
наиболее характерные химические свойства этих
веществ:
1) Все кислоты реагируют с веществами,
содержащими очень сильные частицы-основания: O2 , N3
, N3 и т. п. (см.
рис. 12.2), то есть прежде всего с основными и
амфотерными оксидами (примеры в § 13.4).
и т. п. (см.
рис. 12.2), то есть прежде всего с основными и
амфотерными оксидами (примеры в § 13.4).
2) Все кислоты реагируют с растворами щелочей
(примеры в § 13.7).
3) Растворы сильных кислот реагируют с солями и их
растворами (содержат анионные основания)
H3O + NO2
+ NO2 = HNO2 + H2O,
= HNO2 + H2O,
H3O + CH3COONa = CH3COOH + Na
+ CH3COONa = CH3COOH + Na + H2O,
+ H2O,
HClр + KNO2р = HNO2р + KClр;
HClp + CH3COONaкр = CH3COOHp +
NaClp.
Образующаяся слабая кислота может быть еще и
нерастворимой или летучей:
2H3O + SiO32
+ SiO32 = H2SiO3
= H2SiO3 + 2H2O,
+ 2H2O,
2H3O + FeS = Fe2
+ FeS = Fe2 + H2O + H2S
+ H2O + H2S ,
,
H2SO4 + Na2SiO3 = H2SiO3 + Na2SO4,
+ Na2SO4,
2HBr + FeS = FeBr2 + H2S , что еще более способствует
смещению равновесия вправо.
, что еще более способствует
смещению равновесия вправо.
Летучие кислоты выделяются из реакционной смеси
и в том случае, когда с безводной солью этой
кислоты реагирует нелетучая (точнее, значительно
менее летучая) кислота:
H2SO4конц + NaClкр = NaHSO4кр + HCl ,
,
H3PO4ж + CH3COONaкр = NaH2PO4кр
+ CH3COOH .
.
Если образующаяся слабая кислота неустойчива,
при реакции выделяется газообразный кислотный
оксид. В этом случае растворы сильных кислот
реагируют и с нерастворимыми солями:
2H3O + CaCO3 = Ca2
+ CaCO3 = Ca2 + CO2
+ CO2 + 3H2O,
+ 3H2O,
2HNO3р + CaCO3кр = Ca(NO3)2р + CO2 + H2O.
+ H2O.
Реакции между растворами солей и сильных кислот
протекают и в тех случаях, когда образуется
нерастворимая соль (§ 12.1):
Cl + Ag
+ Ag = AgCl
= AgCl ,
,
HCl + AgNO3 = AgCl  + HNO3.
+ HNO3.
4) Растворы сильных кислот реагируют с металлами,
стоящими в ряду напряжений левее водорода
(примеры в § 13.2).
5) Многие кислоты при нагревании разлагаются
(примеры см. в § 2.5). Некоторые
кислоты легко разлагаются даже в водных
растворах:
H2CO3 = CO2 + H2O (при образовании
практически полностью разлагается),
+ H2O (при образовании
практически полностью разлагается),
H2SO3 = SO2 + H2O (неустойчива в
концентрированных растворах и при нагревании).
+ H2O (неустойчива в
концентрированных растворах и при нагревании).
Растворимые оксокислоты можно получить при
взаимодействии соответствующего кислотного
оксида с водой. Слабые кислоты получаются из
солей под действием сильных кислот.
Бескислородные кислоты получают, растворяя
соответствующие гидриды в воде.
 1.
Предложите способы получения серной, соляной и
фосфорной кислоты.
1.
Предложите способы получения серной, соляной и
фосфорной кислоты.
2.Приведите уравнения реакций, характеризующие
химические свойства а) серной кислоты, б)
кремниевой кислоты, в) соляной кислоты.
3.Осуществите превращения: Cl2  HCl
HCl  CaCl2
CaCl2  AgCl.
AgCl.
4.Сколько тонн 96 %-ной серной кислоты можно
получить из 3 тонн серы при общем выходе продукта,
равном 80 %?
 Химические свойства кислот.
Химические свойства кислот.
13.9. Амфотерные гидроксиды
Как амфотерные оксиды по свойствам
близки к основным оксидам, так и амфотерные
гидроксиды близки по свойствам к основным
гидроксидам (основаниям). Отличие амфотерных
гидроксидов - только в том, что они способны
реагировать со щелочами.
Непосредственно эти реакции протекают только в
растворах:
Zn(OH)2 + 2OH = [Zn(OH)4]2
= [Zn(OH)4]2 , Cr(OH)3 + 3OH
, Cr(OH)3 + 3OH = [Cr(OH)6]3
= [Cr(OH)6]3 ,
,
Zn(OH)2 + 2NaOHр = Na2[Zn(OH)4]р,
Cr(OH)3 + 3KOHр = K3[Cr(OH)6]р.
Конечно, амфотерные гидроксиды реагируют и с
расплавами щелочей, но при этих температурах они
разлагаются, и со щелочью реагируют уже
соответствующие амфотерные оксиды (см.
§ 13.6).
Так как все амфотерные гидроксиды -
нерастворимые вещества, получить их можно
осаждением из растворов солей:
Zn2 + 2OH
+ 2OH = Zn(OH)2
= Zn(OH)2
[Zn(OH)4]2 + 2H3O
+ 2H3O = Zn(OH)2
= Zn(OH)2 + 4H2O.
+ 4H2O.
 Осуществите
превращения:
Осуществите
превращения:
а) Be  BeO
BeO  Na2BeO2
Na2BeO2
 BeCl2
BeCl2  Be(OH)2
Be(OH)2  Na2[Be(OH)4]
Na2[Be(OH)4]
 BeSO4;
BeSO4;
б) Al  Na[Al(H2O)2(OH)4]
Na[Al(H2O)2(OH)4]
 Al(OH)3
Al(OH)3
 Na3[Al(OH)6]
Na3[Al(OH)6]
 AlCl3
AlCl3  Al(OH)3
Al(OH)3  Al2O3 .
Al2O3 .
 Получение и свойства амфотерных гидроксидов.
Получение и свойства амфотерных гидроксидов.
13.10. Соли
Как трудно провести границу между
веществами с ионными и ковалентными связями, так
не менее трудно выделить среди множества
соединений те, которые мы называем солями. Тем не
менее, все соединения, которые заведомо
относятся к солям, представляют собой твердые
(обычно кристаллические) вещества. По
определению, связь в этих соединениях ионная. При
этом не следует забывать, что в сложных катионах
и анионах связь между атомами ковалентная.
Химические свойства солей определяются только
свойствами ионов, входящих в их состав.
Важнейшие химические свойства средних солей:
1) растворимые соли могут реагировать с металлами
(см § 13.2);
2) некоторые соли могут окисляться активными
неметаллами:
2KI + Cl2 = 2KCl + I2,
2K2SO3 + O2 = 2K2SO4 (в
растворе, медленно);
3) растворимые соли могут реагировать с
растворами щелочей (см. § 13.7);
4) соли слабых кислот реагируют с сильными
кислотами (см § 13.8);
5) в растворе соли могут реагировать между собой:
Ba2 + SO42
+ SO42 = BaSO4
= BaSO4 , Ag
, Ag + Cl
+ Cl = AgCl
= AgCl ,
,
BaCl2 + Na2SO4 = BaSO4 + 2NaCl,
AgNO3 + NaCl = AgCl + NaNO3;
+ NaNO3;
6) некоторые соли при нагревании легко
разлагаются
2KNO3 = 2KNO2 + O2 , MgCO3 = MgO + CO2
, MgCO3 = MgO + CO2 , NH4Cl
= NH3
, NH4Cl
= NH3 + HCl
+ HCl ,
,
(NH4)2Cr2O7 = N2 + Cr2O3
+ 4H2O
+ Cr2O3
+ 4H2O , NH4NO2 = N2
, NH4NO2 = N2 + 2H2O
+ 2H2O .
.
Как видно из приведенных примеров, реакции
термического разложения разных солей очень
сильно отличаются друг от друга, поэтому
подробно с некоторыми типами этих реакций вы
познакомитесь при изучении химии отдельных
элементов.
Особенности химических свойств кислых и
основных солей связаны с наличием в их составе
ионов-амфолитов и заключаются в возможности
реакций с растворами кислот и оснований:
NaHSO4р + NaOHр = Na2SO4р
+ H2O,
NaHCO3р + HClр = NaClр + CO2 + H2O,
+ H2O,
Mg(OH)Cl + NaOHр = Mg(OH)2 + NaClр,
Mg(OH)Cl + HClр = MgCl2р + H2O.
Все кислые и основные соли разлагаются
при нагревании. Здесь также много различных
типов реакций:
2NaHCO3 = Na2CO3 + H2O + CO2
+ CO2 ,
,
NH4HCO3 = NH3 + H2O
+ H2O + CO2
+ CO2 ,
,
2Na2HPO4 = Na4P2O7 + H2O ,
,
(CuOH)2CO3 = 2CuO + CO2 + H2O
+ H2O .
.
Изучая предыдущие параграфы этой
главы, вы убедились в том, что соли образуются при
самых разнообразных реакциях. Важнейшие способы
получения средних солей в виде схемы
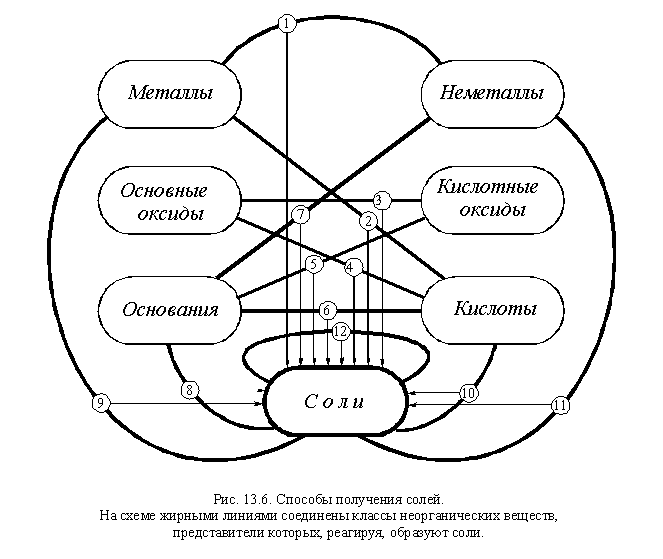
представлены на рис. 13.6.
Таким образом, соли можно получить 12 важнейшими
способами:
1) при взаимодействии металлов с неметаллами,
2) при взаимодействии металлов с кислотами,
3) при взаимодействии основных оксидов с
кислотными оксидами,
4) при взаимодействии основных оксидов с
кислотами,
5) при взаимодействии кислотных оксидов с
основаниями,
6) при взаимодействии оснований с кислотами,
7) при взаимодействии неметаллов с основаниями,
8) при взаимодействии оснований с солями,
9) при взаимодействии металлов с солями,
10) при взаимодействии кислот с солями,
11) при взаимодействии неметаллов с солями,
12) при взаимодействии солей друг с другом.
Не все эти способы применимы к каждой
соли, например: соли бескислородных кислот
нельзя получить, используя способы 3 и 5, а соли
металлов, стоящих в ряду напряжений правее
водорода нельзя получить, используя способ 2. И
наоборот, существует множество способов
получения отдельных солей, не включенных в этот
перечень.
 1.Составьте уравнения реакций получения а)
сульфата магния (не менее восьми способов), б)
карбоната кальция (не менее четырех способов), в)
сульфида калия (не менее трех способов).
1.Составьте уравнения реакций получения а)
сульфата магния (не менее восьми способов), б)
карбоната кальция (не менее четырех способов), в)
сульфида калия (не менее трех способов).
2.Какими из 12 приведенных в тексте параграфа
способами нельзя получить хлорид натрия?
 Получение
и химические свойства солей.
Получение
и химические свойства солей.
13.11. Прогнозирование свойств простых
веществ и соединений на основе естественной
системы элементов
Вы изучили характерные свойства
веществ, относящихся к важнейшим классам простых
веществ и соединений. Но как определить, к какому
классу относится данное конкретное вещество?
Очень часто в этом может помочь естественная
система элементов. Кроме того, ЕСЭ может помочь
проследить усиление или ослабление тех или иных
свойств аналогичных соединений разных
элементов.
а) Простые вещества
Где в таблице элементов проходит
граница между простыми веществами-металлами и
неметаллами, вы знаете (§ 2.5, § 7.14). Основываясь на типе
химической связи, уточним эту границу. На рисунке
13.7 светлыми символами показаны элементы, в
обычных условиях образующие простые вещества с
ковалентными связями между атомами - неметаллы.
Такими же символами обозначены элементы
благородных газов, связи между атомами в которых
- межмолекулярные. В простых веществах остальных
элементов - связь металлическая.
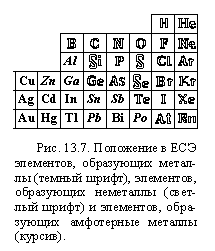
По способности реагировать со
щелочами среди металлов выделяют амфотерные
металлы (символы их элементов набраны
курсивом)(Кроме отмеченных в таблице слабо
выраженные амфотерные свойства проявляют
железо, титан и ниобий.Эти вещества могут
реагировать со щелочью, но в очень жестких
условиях. Некоторые металлы (например, кобальт)
реагируют с расплавами щелочей в присутствии
кислорода , то есть окисляются кислородом в
шелочной среде, но это свойство уже не имеет
отношение к амфотерности). Как видно из рисунка,
они находятся на границе между металлами и
неметаллами.
Важнейшие свойства металлов -
восстановительные. При всей неравномерности
изменения этих свойств в системе элементов самые
сильные металлы-восстановители образованы
элементами, расположенными в левом нижнем углу
таблицы (их атомы наиболее склонны отдавать
электроны).
Важнейшие свойства неметаллов -
окислительные. Исключая VIIIА группу,
окислительные свойства неметаллов возрастают
снизу вверх и слева направо (в соответствии с
возрастанием склонности к присоединению
электронов их атомами).

б) Оксиды
Определение характера оксида по
положению элемента в ЕСЭ осложнено тем, что
элементы, как правило, образуют несколько
оксидов (в разных степенях окисления). Например,
хром образует следующие устойчивые оксиды:
CrO, оксид хрома(II) - основный оксид;
Cr2O3, оксид хрома(III) - амфотерный оксид;
CrO3, оксид хрома(VI) - кислотный оксид.
Как видите, с увеличением степени окисления
характер оксида меняется, переходя от основного
к кислотному. Эта закономерность наблюдается и у
других элементов.
Состав высших оксидов (за исключением элементов
VIIIВ и IB группы) зависит от номера группы:
IA |
IIA, IIB |
IIIA, IIIB |
IVA, IVB |
VA, VB |
VIA, VIB |
VIIA, VIIB |
VIIIA |
Э2О |
ЭО |
Э2О3 |
ЭО2 |
Э2О5 |
ЭО3 |
Э2О7 |
ЭО4 |
Характер высших оксидов s-, p- и d-элементов
показан на рисунке 13.8.
Свободные клетки этой таблицы означают
отсутствие у данного элемента высшего оксида,
аналогичного другим оксидам данной группы
элементов и соответствующего номеру группы.
Для s- и p-элементов прослеживается
следующие закономерности:
а) кислотный характер высших оксидов усиливается
слева направо и снизу вверх;
б) основный характер высших оксидов усиливается
в противоположном направлении.
в) Гидроксиды
Типичный состав гидроксидов s- и p-элементов
следующий:
IA |
IIA, IIB |
IIIA, IIIB |
IVA, IVB |
VA, VB |
VIA, VIB |
VIIA, VIIB |
VIIIA |
ЭОН |
Э(ОН)2 |
Э(ОН)3
ЭОН |
Н4ЭО4
Н2ЭО3 |
Н3ЭО4
НЭО3
НЭО2 |
Н6ЭО6
Н2ЭО4
Н2ЭО3 |
НЭО4
НЭО3
НЭО2
НЭО |
(Н4ЭО6) |
Независимо от типа химической связи,
состав высших гидроксидов выражается формулой
Э(ОН)n, где n равно номеру группы.
Например, NaOH, Ca(OH)2, B(OH)3 или H3BO3,
Te(OH)6 или H6TeO6 и т. д.
Эта общая формула справедлива для всех элементов
IA, IIA, IIB, IIIA и IIIB групп. Атомы остальных элементов
(кроме элементов IB группы), как правило, не могут
удержать вокруг себя столько гидроксильных
групп, теряют воду и превращаются в
оксид-гидроксиды (метагидроксиды). Например,
вместо " ортосерной" кислоты S(OH)6 или H6SO6
сера образует обычную серную кислоту H2SO4
или SO2(OH)2, но для теллура аналогичная
ортокислота существует - это уже упомянутая
ортотеллуровая кислота H6TeO6.
Существует ортокислота и у кремния - H4SiO4
(ортокремневая), но не существует у углерода.
Склонность элементов правого верхнего угла
длиннопериодной таблицы образовывать вместо
ортогидроксидов метагидроксиды объясняется
уменьшением в этом направлении радиусов атомов,
что приводит к уменьшению максимально
возможного координационного числа (числа
ближайших соседей) и возрастанию энергии двойных
связей между атомами элемента и атомами
кислорода. Обратите внимание, что при переходе от
ортогидроксида к метагидроксиду степень
окисления центрального атома остается прежней.
Почему же кислоту H3PO4 называют
ортофосфорной? Исторически сложилось так, что
" ортокислотами" называют кислоты не с
максимально возможным теоретически числом
гидроксильных групп в молекуле, а с практически
максимальным. Фосфор не образует гидроксида P(OH)5
(координационное число 5), максимально возможное
число гидроксильных групп у него в кислоте PO(OH)3
или H3PO4 (координационное число 4) - ее и
называют ортофосфорной.
Кислотно-основный характер гидроксидов и его
изменение в ЕСЭ соответствуют аналогичным
характеристикам оксидов. Сила молекулярных
оксокислот существеннейшим образом зависит от
строения их молекул:
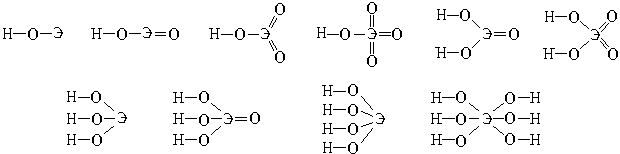
Чем больше в молекуле кислоты атомов
кислорода, связанных с центральным атомом
двойными связями, тем сильнее эта кислота.
Причины такой зависимости кислотных свойств от
строения связаны с различной устойчивостью
анионов, образующихся в результате потери
молекулами кислот своих протонов. Сравним две
кислоты: HClO2 и HClO3. В результате
реакций нейтрализации из них образуются ионы ClO2 и ClO3
и ClO3 .
Структурные формулы этих ионов:
.
Структурные формулы этих ионов:
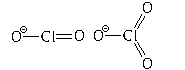
Экспериментально установлено, что два
атома кислорода в хлорит-ионе абсолютно
одинаковы. Точно также абсолютно одинаковы и три
атома кислорода в хлорат-ионе. Соответственно,
одинаковы и заряды этих атомов кислорода.
Следовательно, структурные формулы этих ионов
должны записываться следующим образом:
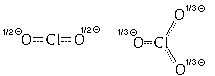
Дробные частичные заряды в таких формулах
означают, что " лишний" электрон с равной
вероятностью можно обнаружить в каждом из атомов
кислорода. Иными словами, частичный заряд
оказывается рассредоточен (" размазан" ,
делокализован) по всем атомам кислорода. При
прочих равных условиях, чем меньше частичный
заряд на каждом из атомов, тем устойчивее данный
анион (это непосредственно следует из закона
Кулона: меньше заряд  меньше силы отталкивания
меньше силы отталкивания  меньше
энергия частицы). Отсюда следует, что образование
хлорат-иона энергетически более выгодно, чем
образование хлорит иона, и, следовательно,
кислота HClO3 сильнее, чем HClO2.
меньше
энергия частицы). Отсюда следует, что образование
хлорат-иона энергетически более выгодно, чем
образование хлорит иона, и, следовательно,
кислота HClO3 сильнее, чем HClO2.
г) Водородные соединения (гидриды)
Закономерное изменение состава
водородных соединений в системе элементов можно
проследить только для гидридов с ионной или
ковалентной связью. Простейшие формулы таких
гидридов с максимальным содержанием водорода
(" высших гидридов" ) можно определить по
номеру группы:
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
ЭН |
ЭН2 |
Э2Н6 |
ЭН4 |
ЭН3 |
Н2Э |
НЭ |
- |
Состав ионных гидридов (IA и IIA группы)
зависит от заряда катиона соответствующего
элемента, а состав ковалентных гидридов - от
максимального числа неспаренных электронов,
имеющихся у атома этого элемента (для IVA группы - в
возбужденном состоянии).
Ионные гидриды, содержащие ионы Н - сильнейшие
анионные основания. Ковалентные гидриды
элементов IIIA и IVA групп кислотно-основными
свойствами не обладают. Гидриды элементов IIIA
группы - слабые основания, а гидриды элементов VIA
и VIIA групп - кислоты (кроме воды - амфолита), причем
галогеноводородные кислоты (кроме HF) - сильные
кислоты. В группах сила этих кислот возрастает с
увеличением порядкового номера элемента, что
связано с увеличением радиуса атома и, как
следствие этого, с уменьшением прочности связи Э-
Н, а так же с большей устойчивостью (в этих
условиях!) больших анионов.
- сильнейшие
анионные основания. Ковалентные гидриды
элементов IIIA и IVA групп кислотно-основными
свойствами не обладают. Гидриды элементов IIIA
группы - слабые основания, а гидриды элементов VIA
и VIIA групп - кислоты (кроме воды - амфолита), причем
галогеноводородные кислоты (кроме HF) - сильные
кислоты. В группах сила этих кислот возрастает с
увеличением порядкового номера элемента, что
связано с увеличением радиуса атома и, как
следствие этого, с уменьшением прочности связи Э-
Н, а так же с большей устойчивостью (в этих
условиях!) больших анионов.