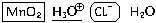С. Т. Жуков Химия-10/11класс
18. Окислительно-восстановительные реакции
18.1. Электронно-ионный баланс
Какие химические реакции относятся к
окислительно-восстановительным, вы узнали,
изучая главу IX; тогда же вы научились составлять
уравнения этих реакций методом электронного
баланса. В этой главе вы познакомитесь с
особенностями протекания ОВР в водных растворах
и со специфическим для таких реакций методом
составления их уравнений.
Особенностью ОВР в растворах (в частности, в
водных) является возможность участия в этих
реакциях растворителя (воды), а также продуктов
автопротолиза растворителя (в случае воды –
ионов оксония и гидроксид-ионов). В случае водных
растворов это приводит к возможности протекания
между одними и теми же исходными веществами
разных реакций в разных средах: кислотной,
нейтральной или щелочной. Так, между KMnO4 и KNO2
в растворе в зависимости от реакции среды могут
протекать следующие химические реакции:
2MnO4 + 5NO2
+ 5NO2 + 6H3O
+ 6H3O = 2Mn
= 2Mn + 5NO3
+ 5NO3 + 9H2O
(кислотная среда);
+ 9H2O
(кислотная среда);
2MnO4 + 3NO2
+ 3NO2 + H2O = 2MnO2 + 3NO3
+ H2O = 2MnO2 + 3NO3 + 2OH
+ 2OH (нейтральная среда);
(нейтральная среда);
2MnO4 + NO2
+ NO2 + 2OH
+ 2OH = 2MnO4
= 2MnO4 + NO3
+ NO3 + H2O
(щелочная среда).
+ H2O
(щелочная среда).
Если известны все исходные вещества и продукты
реакции, то, составляя уравнения таких реакций,
можно пользоваться методом электронного
баланса. Если же участники реакции не очевидны,
то удобнее использовать метод
электронно-ионного баланса (другое название – метод
полуреакций). Использование этого (более
сложного) метода оправдано еще и тем, что
коэффициенты в уравнениях ОВР, протекающих в
растворах, бывают довольно большими,(известна,
например, реакция между тремя неорганическими
веществами, сумма коэффициентов в уравнении
которой равна 8600) и их подбор методом
электронного баланса оказывается очень
трудоемким.
Рассмотрим метод электронно-ионного баланса на
примере реакции диоксида марганца с соляной
кислотой (реакция используется в лабораториях
для получения хлора).
1. Запишем, какие реально существующие
вещества и частицы имеются в нашей химической
системе до начала реакции. Составляя этот
перечень, обратим внимание на то, что
- из нерастворимых веществ в нашей системе
присутствует только MnO2,
- соляная кислота – кислота сильная, и в
растворе нет молекул HCl,
- вода (соляная кислота – раствор хлороводорода в
воде), наоборот, практически полностью состоит из
молекул..
MnO2, H3O , Cl
, Cl , H2O
, H2O
2. Для наглядности выделим окислитель (в
данном случае MnO2), взяв его формулу в
прямоугольную рамочку, и восстановитель (в
данном случае Cl ) –
в овальную рамочку. Подчеркнем ион, определяющий
реакцию среды (ион H3O+ – среда кислотная):
) –
в овальную рамочку. Подчеркнем ион, определяющий
реакцию среды (ион H3O+ – среда кислотная):
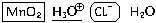
3. Запишем уравнение полуреакции
восстановления окислителя. Эта операция
разделяется на два этапа. На первом – добиваемся
материального баланса (в правой и левой частях
уравнения полуреакции – одинаковые атомы в
равных количествах), а на втором этапе –
зарядового (заряд в правой части уравнения равен
заряду в левой).
Известно, что все соединения марганца в
кислотной среде, восстанавливаясь, превращаются
в ионы марганца(2 ), следовательно
), следовательно
MnO2  Mn2
Mn2
В левой части схемы полуреакции присутствуют
два " лишних" атома кислорода в степени
окисления –II, которые в реакции не меняют своей
степени окисления. Поскольку ион O2A,
являясь очень сильным основанием, в водном
растворе существовать не может, атомы кислорода
в кислотной среде могут быть связаны ионами
оксония с образованием молекул воды:
MnO2 + 4H3O
 Mn
Mn + 6H2O
+ 6H2O
На этом этапе мы достигли материального
баланса. Однако заряд в левой части схемы
полуреакции не равен заряду в правой части (+4 е и
+2 е). Для уравнивания зарядов прибавим в левой
части полуреакции 2 электрона. Уравнение
полуреакции окислителя готово:
MnO2 + 4H3O + 2e– = Mn
+ 2e– = Mn + 6H2O
+ 6H2O
4. Запишем уравнение полуреакции
восстановителя. При этом можно пользоваться
следующим правилом: восстановитель обычно
окисляется до ближайшей устойчивой в данных
условиях степени окисления. Для хлора такой
ближайшей степенью окисления будет ноль,
следовательно, образуется газообразный хлор:
Cl
 Cl2
Cl2
Материальный баланс достигается в этом случае
очень просто:
2Cl
 Cl2
Cl2
Для уравнивания заряда отнимем в левой части
полуреакции два электрона:
2Cl –2е–
= Cl2
–2е–
= Cl2
5. Запишем теперь оба уравнения полуреакций в
виде системы уравнений
MnO2 + 4H3O  + 2e– = Mn2
+ 2e– = Mn2 + 6H2O
+ 6H2O
2Cl –2е– = Cl2
–2е– = Cl2
В данном случае число отданных электронов
равно числу принятых.
6. Если сложить эти два уравнения (в данном
случае не домножая на дополнительные множители),
то электроны сократятся, и мы получим ионное
уравнение реакции.
MnO2 + 4H3O + 2Cl
+ 2Cl = Mn2
= Mn2 + 6H2O + Cl2
+ 6H2O + Cl2 
7. Для написания молекулярного уравнения нам
придется вернуться к самому началу наших
рассуждений и вспомнить, что источником ионов
оксония в нашей системе были только молекулы
хлороводорода. Следовательно, четыре иона
оксония образовались из четырех молекул HCl, а
ионы марганца при удалении воды свяжутся с
хлоридными ионами, образовав хлорид марганца(II):
MnO2 + 4HCl = MnCl2 +2H2O + Cl2 
Два " лишних" хлорид-иона, добавленные нами
в левой части уравнения, пошли на образование
одной формульной единицы хлорида марганца(II).
Четыре из шести образовавшихся молекул воды "
входили в состав" ионов оксония и поэтому в
молекулярном уравнении не учитываются.
Таким образом, алгоритм составления уравнения
ОВР методом электронно-ионного баланса таков:
- Составить перечень веществ и частиц,
присутствующих в системе до начала реакции.
- Найти среди них окислитель и восстановитель;
определить реакцию среды.
- Составить уравнение полуреакции окислителя.
- Составить уравнение полуреакции
восстановителя.
- Уравнять число принятых и отданных электронов.
- Составить ионное уравнение.
- Составить молекулярное уравнение.
Составляя этим методом уравнений ОВР,
необходимо учитывать следующие основные
правила:
1) при составлении уравнений полуреакций можно
использовать только те вещества и частицы,
которые присутствуют в данной системе;
2) продуктами полуреакций могут быть только те
вещества и частицы, которые устойчивы в
данной системе;
3) при составлении уравнения полуреакции
окислителя нельзя использовать частицы
восстановителя и наоборот, при составлении
уравнения полуреакции восстановителя нельзя
использовать частицы окислителя.
В рамках так называемой " теории
электролитической диссоциации"
(устаревшая, но все еще широко применяемая в
учебной литературе теория, не учитывающая
существование немолекулярных веществ и
предполагающая самостоятельное сущесвование
ионов водорода), вместо H3O записывают H
записывают H . В этом случае процесс составления
уравнения выглядит следующим образом
. В этом случае процесс составления
уравнения выглядит следующим образом
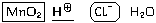
MnO2 + 4H + 2e– = Mn2
+ 2e– = Mn2 + 2H2O
+ 2H2O
2Cl –2е– = Cl2
–2е– = Cl2
MnO2 + 4H + 2Cl
+ 2Cl = Mn2
= Mn2 + 2H2O + Cl2
+ 2H2O + Cl2 
MnO2 + 4HCl = MnCl2 +2H2O + Cl2
18.2. ОВР соединений марганца
Как вы уже знаете, в кислотной,
нейтральной или щелочной среде ОВР одних и тех же
окислителей и восстановителей часто протекают с
образованием различных продуктов реакции.
Рассмотрим подробнее
окислительно-восстановительные свойства
соединений марганца, проявляемые ими в разных
условиях.
При проведении ОВР для создания в растворе
кислотной среды обычно используют серную
кислоту. Азотную кислоту используют крайне
редко, так как она сама является сильным
окислителем; соляную, бромоводородную и
йодоводородную кислоты не используют из-за их
способности к окислению. Щелочная среда
создается добавлением в раствор гидроксидов
натрия или калия.
Для марганца известны соединения, в которых он
проявляет все возможные степени окисления: от
нуля до +VII. В ОВР, протекающих в растворах, чаще
всего участвуют соединения марганца в степенях
окисления +II, +IV, +VII и, отчасти, +VI. Соединения
марганца(II) проявляют слабо выраженные
восстановительные свойства. Соединения,
содержащие марганец в степенях окисления +IV, +VI и
+VII, – более или менее сильные окислители.
Наиболее сильными окислителями являются
соединения марганца в степени окисления +VII.
Металлический марганец – довольно активный
восстановитель.
Условия протекания
окислительно-восстановительных превращений для
соединений марганца можно представить в виде
схемы, приведенной на рисунке 2.
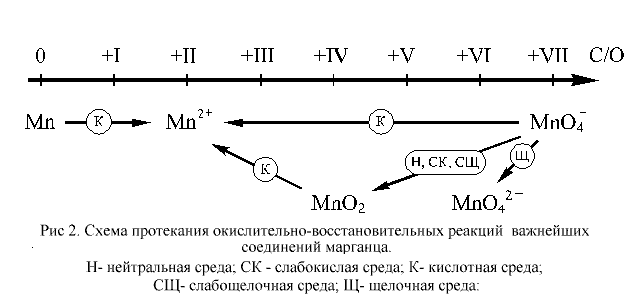
Как видно из приведенной на этом рисунке схемы,
перманганат-ион, входящий в состав самого
популярного в лабораторной практике окислителя, KMnO4,
в различных средах восстанавливается по-разному.
В наибольшей степени окислительные свойства
перманганат калия проявляет в кислотной среде, в
несколько меньшей – в нейтральной и в наименьшей
степени – в щелочной. Рассмотрим эти случаи на
конкретных примерах.
Пример 1. Составьте уравнение реакции,
протекающей при пропускании диоксида серы через
подкисленный серной кислотой раствор
перманганата калия.
Для составления уравнения воспользуемся
методом электронно-ионного баланса.
1 и 2. 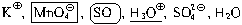
При составлении уравнений ОВР наличием в
растворе гидросульфатных ионов обычно
пренебрегают. (Наличием ионов HSO4 нельзя пренебрегать при
составлении уравнений ОВР типа
взаимодействия концентрированной H2SO4
с NaBr (среди прочего образуется NaHSO4), но
уравнения этих реакций составляют, используя
метод электронного балланса.)
нельзя пренебрегать при
составлении уравнений ОВР типа
взаимодействия концентрированной H2SO4
с NaBr (среди прочего образуется NaHSO4), но
уравнения этих реакций составляют, используя
метод электронного балланса.)
3 – 5. В кислотной среде ион MnO4 восстанавливается до
иона Mn2
восстанавливается до
иона Mn2 . "
Лишние" атомы кислорода(–II) свяжутся ионами H3O
. "
Лишние" атомы кислорода(–II) свяжутся ионами H3O с образованием воды.
Диоксид серы в присутствии сильных окислителей
проявляет восстановительные свойства. При этом
сера(IV) окисляется до ближайшей устойчивой
степени окисления, то есть, до степени окисления
+VI. Нетрудно убедиться, что единственной
частицей, содержащей серу(VI) и устойчивой в
водном растворе, будет сульфатный ион
(действительно, SO3 в водном растворе
образоваться не может, так как реагирует с водой,
давая H2SO4; молекулы серной кислоты
(сильная кислота) в разбавленном водном растворе
также не модут образоваться). Недостающие атомы
кислорода(–II) могут быть " позаимствованы" у
молекул воды с образованием ионов оксония, что в
кислотной среде вполне допустимо
с образованием воды.
Диоксид серы в присутствии сильных окислителей
проявляет восстановительные свойства. При этом
сера(IV) окисляется до ближайшей устойчивой
степени окисления, то есть, до степени окисления
+VI. Нетрудно убедиться, что единственной
частицей, содержащей серу(VI) и устойчивой в
водном растворе, будет сульфатный ион
(действительно, SO3 в водном растворе
образоваться не может, так как реагирует с водой,
давая H2SO4; молекулы серной кислоты
(сильная кислота) в разбавленном водном растворе
также не модут образоваться). Недостающие атомы
кислорода(–II) могут быть " позаимствованы" у
молекул воды с образованием ионов оксония, что в
кислотной среде вполне допустимо
| 2 |
MnO4 + 8H3O + 8H3O + 5e– = Mn2
+ 5e– = Mn2 + 12H2O + 12H2O |
| 5 |
SO2 + 6H2O – 2e– = SO42 + 4H3O + 4H3O |
6. После умножения каждого из уравнений
полуреакций на соответствующие множители,
сложения уравнений и приведения подобных членов
получаем ионное уравнение.
2MnO4 + 5SO2 + 6H2O = 2Mn2
+ 5SO2 + 6H2O = 2Mn2 + 5SO42
+ 5SO42 + 4H3O
+ 4H3O
7. Добавив в левой части уравнения
необходимое количество противоионов и не
забывая о них при написании формул продуктов
реакции, запишем молекулярное уравнение:
2KMnO4 + 5SO2 + 2H2O = 2MnSO4
+ 2H2SO4 + K2SO4
Из уравнения видно, что серная кислота, которая
по смыслу задания должна была вступить в реакцию,
в действительности в реакцию не вступает, а,
наоборот, в процессе реакции выделяется, то есть
добавлена в раствор только как
средообразователь. Но это скорее исключение,
чем правило. Убедимся в этом на другом примере.
Пример 2. Составьте уравнение реакции,
протекающей при добавлении раствора азотистой
кислоты к подкисленному раствору перманганата
калия.
1 – 2. 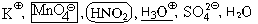
3 – 5. Азотистая кислота – кислота слабая,
поэтому в растворе она присутствует в основном в
виде молекул. Она легко окисляется при
добавлении сильных окислителей. При этом степень
окисления азота повышается до ближайшей
устойчивой, то есть до +V (устойчивый в газовой
фазе диоксид азота в воде диспропорционирует).
Единственная частица, содержащая атом азота(V) и
устойчивая в водном растворе – нитрат-ион.
| 2 |
MnO4 + 8H3O+ 5e– = Mn2 + 8H3O+ 5e– = Mn2 + 12H2O + 12H2O |
| 5 |
HNO2 + 4H2O – 2e– = NO3 + 3H3O+ + 3H3O+ |
6. Ионное уравнение
2MnO4 + H3O
+ H3O + 5HNO2
= 2Mn2
+ 5HNO2
= 2Mn2 + 4H2O + 5NO3
+ 4H2O + 5NO3
7. При переходе от ионного уравнения к
молекулярному первое приходится удваивать, так
как одна молекула серной кислоты образует два
иона оксония.
4KMnO4p + H2SO4p + 10HNO2p =
MnSO4p + 3Mn(NO3)2p + 6H2O + 4KNO3p
Это уравнение можно записать и по-другому:
4KMnO4p + H2SO4p + 10HNO2p =
4Mn(NO3)2p + 6H2O + 2KNO3p + K2SO4p
Оба уравнения правильные, так как отражают
процесс, протекающий в растворе. При удалении
воды кристаллизоваться будут все четыре соли [MnSO4,
Mn(NO3)2, K2SO4, KNO3] причем
в соотношении, определяемом их растворимостью, а
не коэффициентами в каком-либо из уравнений.
Пример 3. Составьте уравнение реакции,
протекающей при сливании раствора перманганата
калия с раствором аммиака.
1 – 2. 
3 – 5. Аммиак – слабое основание, поэтому
среда в его водном растворе слабощелочная, и
перманганат-ион в этих условиях при
восстановлении превращается в диоксид марганца,
выпадающий из раствора в виде бурого осадка. В
нейтральной и щелочной среде очень мало ионов
оксония, поэтому для связывания " лишних"
атомов кислорода(–II) могут быть использованы
лишь молекулы воды. Каждая молекула воды,
присоединяя один атом кислорода(–II),
превращается в два гидроксид-иона. Аммиак в этих
условиях окисляется до азота (ближайшая
устойчивая степень окисления – ноль).
| 2 |
6 |
MnO4 + 2H2O + 3e– = MnO2 + 4OH + 2H2O + 3e– = MnO2 + 4OH |
| 1 |
3 |
2NH3 + 6H2O – 6e– = N2
+ 6H3O |
6. 2MnO4 + 10H2O + 2NH3 = 2MnO2 + 8OH
+ 10H2O + 2NH3 = 2MnO2 + 8OH + N2
+ N2 + 6H3O
+ 6H3O
Так как в одной из полуреакций образуются
гидроксид-ионы, а в другой – " ионы водорода"
, что вполне допустимо в нейтральной (или близкой
к ней) среде, перед приведением подобных членов в
ионном уравнении необходимо учесть, что эти ионы
одновременно в водном растворе существовать не
могут (пройдет реакция нейтрализации).
2MnO4 + 4H2O
+ 2NH3 = 2MnO2 + 2OH
+ 4H2O
+ 2NH3 = 2MnO2 + 2OH + N2 + 6H2O
+ N2 + 6H2O
После приведения подобных членов получаем
ионное уравнение:
2MnO4 + 2NH3
= 2MnO2 + 2OH
+ 2NH3
= 2MnO2 + 2OH + N2
+ N2 + 2H2O
+ 2H2O
7. 2KMnO4 + 2NH3 = 2MnO2 + 2KOH + N2 + 2H2O
+ 2H2O
Пример 4. Составить уравнение реакции,
протекающей при сливании раствора перманганата
калия с раствором сульфита калия в присутствии
гидроксида калия.
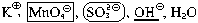
| 2 |
MnO4 + e– = MnO42 + e– = MnO42 |
| 1 |
SO32 + 2OH + 2OH – 2e–
= SO42 – 2e–
= SO42 + H2O + H2O |
2MnO4 + SO32
+ SO32 + 2OH
+ 2OH = 2MnO42
= 2MnO42 + SO42
+ SO42 + H2O
+ H2O
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4
+ H2O
Источником " недостающего" атома
кислорода(–II) в щелочной среде могут быть только
два гидроксидных иона, при попытке использовать
молекулу воды или один гидроксидный ион
образуются свободные ионы оксония, что в
щелочной среде невозможно.
Диоксид марганца MnO2 в кислотной
среде, как вы уже знаете, также проявляет
свойства сильного окислителя, например, окисляет
не только хлорид-ион до хлора, но и нитрит-ион до
нитрат-иона, йодид-ион до йода и т. д. В свою
очередь сам диоксид марганца получается при
взаимодействии перманганата калия с растворами
солей марганца(II) по реакции конмутации
2MnO4 + 3Mn2
+ 3Mn2 + 6H2O = 5MnO2
+ 4H3O
+ 6H2O = 5MnO2
+ 4H3O
А устойчивый только в сильно щелочных
растворах манганат калия K2MnO4 уже
при незначительном подкислении и даже при
разбавлении раствора водой диспропорционирует:
3MnO42 + 2H2O = 2MnO4
+ 2H2O = 2MnO4 + MnO2 + 4OH
+ MnO2 + 4OH
Очень сильным окислителем является оксид
марганца(VII). Это кислотный оксид (при обычных
условиях жидкость), активно реагирующий с водой
Mn2O7 + H2O = 2HMnO4
и поглощающий ее из воздуха. Он легко окисляет
аммиак (до N2), сероводород (до SO2),
сульфиды (до сульфатов), монооксид углерода и
органические вещества (до CO2), сам при этом
восстанавливаясь до MnO2.
18.3. ОВР соединений хрома
Как и марганец, хром также образует, соединения,
в которых проявляет самые разнообразные степени
окисления. Соединения хрома в низших степенях
окисления являются восстановителями, а в высших
– окислителями. Более или менее устойчивыми
являются степени окисления О, +II, +III, и +VI (из них
самая устойчивая +III). Как и для марганца, условия
протекания окислительно-восстановительных
превращений соединений хрома можно изобразить в
виде схемы (см рис. 3).
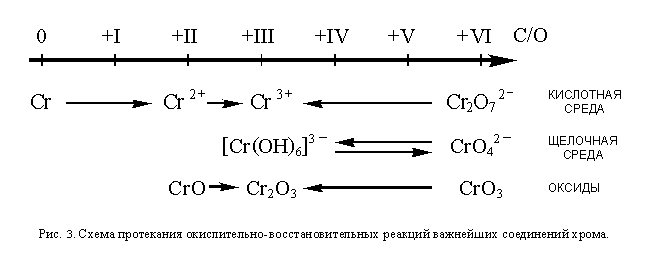
В отличие от перманганат-иона, устойчивого как
в кислотной, так и в щелочной среде, хромат-ион
устойчив только в щелочной и, отчасти, в
нейтральной среде. В кислотной среде хромат-ион
превращается в дихромат-ион по реакции
2CrO42 + 2H3O
+ 2H3O = Cr2O72
= Cr2O72 + 3H2O
+ 3H2O
Дихромат-ион, в свою очередь, устойчив только в
кислотной и, отчасти, в нейтральной среде, а в
щелочной превращается в хромат-ион:
Cr2O72 + 2OH
+ 2OH = 2CrO42
= 2CrO42 + H2O
+ H2O
Поэтому в кислотной среде протекают
окислительно-восстановительные процессы только
с участием иона Cr2O72 , а в щелочной – только с участием
иона CrO42
, а в щелочной – только с участием
иона CrO42 . Так
как в кислотной среде окислительные свойства
кислотных остатков оксокислот всегда
проявляются сильнее, чем в щелочной, дихромат-ион
значительно более сильный окислитель, чем
хромат-ион. И наоборот,
гексагидроксохромат(III)-ионы, существующие
только в щелочной среде, легко окисляются до
хроматов(VI) такими сильными окислителями, как
хлор, бром или пероксид водорода.
. Так
как в кислотной среде окислительные свойства
кислотных остатков оксокислот всегда
проявляются сильнее, чем в щелочной, дихромат-ион
значительно более сильный окислитель, чем
хромат-ион. И наоборот,
гексагидроксохромат(III)-ионы, существующие
только в щелочной среде, легко окисляются до
хроматов(VI) такими сильными окислителями, как
хлор, бром или пероксид водорода.
Как и металлический марганец, хром проявляет
восстановительные свойства, легко окисляясь
ионами оксония (без доступа кислорода – до Cr2 , на воздухе – до Cr3
, на воздухе – до Cr3 ). Ион Cr2
). Ион Cr2 , в отличие от Mn2
, в отличие от Mn2 , – очень сильный восстановитель;
он легко окисляется кислородом воздуха,
восстанавливает ионы Fe3
, – очень сильный восстановитель;
он легко окисляется кислородом воздуха,
восстанавливает ионы Fe3 до Fe2
до Fe2 , а также
вступает и в другие ОВР.
, а также
вступает и в другие ОВР.
Кристаллический триоксид хрома – очень
сильный окислитель. Как и оксид марганца(VII), это
кислотный оксид, легко реагирующий с водой с
образованием хромовой кислоты H2CrO4.
Следовательно, в ОВР он может вступать только в
твердом виде. В частности, органические вещества
при соприкосновении с CrO3 окисляются до
углекислого газа, сероводород – до SO2,
аммиак – до азота.
Составление уравнений ОВР с участием растворов
соединений хрома полностью аналогично
составлению уравнений реакций в случае
соединений марганца, поэтому здесь приводятся
лишь уравнения полуреакций ионов, содержащих
хром:
Cr2O72 +
14H3O
+
14H3O + 6e–
= 2Cr3
+ 6e–
= 2Cr3 + 21H2O
+ 21H2O
CrO42 + 4H2O
+ 3e– = [Cr(OH)6]3
+ 4H2O
+ 3e– = [Cr(OH)6]3 + 2OH
+ 2OH
[Cr(OH)6]3 + 2OH
+ 2OH – 3e– = CrO42
– 3e– = CrO42 + 4H2O
+ 4H2O
Cr2 – e– = Cr3
– e– = Cr3
18.4. ОВР азотной и серной кислот
Азотная кислота и ее растворы – сильные
окислители. Концентрированные растворы азотной
кислоты окисляют большинство металлов (кроме
золота, платины, тантала и некоторых других),
многие неметаллы (бор, графит, серу, фосфор и др.) и
многие сложные вещества (сероводород, сульфиды,
низшие оксиды меди и железа, многие органические
вещества и др.) С железом, алюминием, хромом и
некоторыми другими металлами концентрированная
азотная кислота реагирует с образованием
плотных кислородсодержащих покрытий,
препятствующих дальнейшему окислению металла;
это явление называется " пассивацией" металла.
С уменьшением концентрации азотной кислоты (с
разбавлением) ее окислительная активность
уменьшается, что отчасти связано с уменьшением
числа молекул HNO3 и увеличением числа ионов
NO3 . Почти
полностью окислительные свойства исчезают в
растворах нитратов. С разбавлением азотной
кислоты сужается круг восстановителей, с
которыми она может реагировать, но увеличиваются
скорости многих реакций.
. Почти
полностью окислительные свойства исчезают в
растворах нитратов. С разбавлением азотной
кислоты сужается круг восстановителей, с
которыми она может реагировать, но увеличиваются
скорости многих реакций.
При взаимодействии растворов азотной кислоты с
восстановителями почти всегда образуются смеси
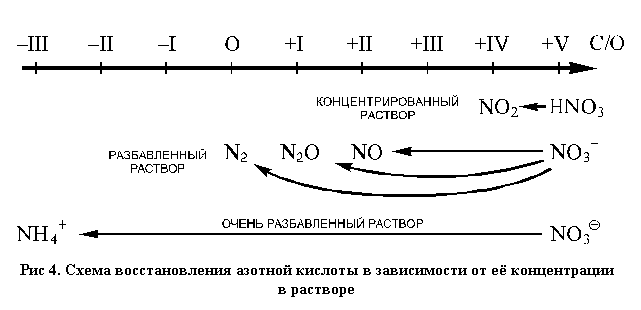
продуктов, содержащих азот в различных степенях
окисления (N2O помещен на схеме под степенью
окисления +I условно, так как это усредненная
степень окисления атомов азота в этом
соединении. Истинные степени окисления здесь +I и
+III. Также условно соединение это называется
"оксид азота (I)" (см. рис. 4).
Однако во многих случаях можно выделить
преимущественные направления реакций, то есть те
реакции, продукты которых преобладают.
Так, в концентрированном растворе при
спокойном протекании реакции (без взрыва или
разброса веществ) азотная кислота
восстанавливается до диоксида азота:
HNO3 + H3O + e– = NO2 + 2H2O или HNO3
+ H
+ e– = NO2 + 2H2O или HNO3
+ H + e– = NO2
+ H2O
+ e– = NO2
+ H2O
По мере разбавления раствора в продуктах
реакции появляется монооксид азота:
NO3 +
4H3O
+
4H3O + 3e– =
NO + 6H2O или NO3
+ 3e– =
NO + 6H2O или NO3 + 4H
+ 4H + 3e– = NO + 2H2O
+ 3e– = NO + 2H2O
При дальнейшем разбавлении могут протекать и
два других процесса:
2NO3 +
10H3O
+
10H3O + 8e–
= N2O + 15H2O или 2NO3
+ 8e–
= N2O + 15H2O или 2NO3 + 10H
+ 10H + 8e– = N2O + 5H2O
+ 8e– = N2O + 5H2O
2NO3 + 12H3O
+ 12H3O + 10e– = N2 + 18H2O
или 2NO3
+ 10e– = N2 + 18H2O
или 2NO3 + 12H
+ 12H + 10e– = N2 + 6H2O
+ 10e– = N2 + 6H2O
Три последние реакции в той или иной степени
сопровождают друг друга. Соотношение
газообразных продуктов зависит не только от
концентрации кислоты и активности
восстановителя, но и от температуры, которая во
время реакции обычно не бывает постоянной.
Поэтому преимущественное направление в каждом
конкретном случае определяется
экспериментально. Кроме того, в процессе реакции
кислота расходуется, и ее концентрация
понижается, что приводит к изменению соотношения
продуктов реакции во времени. Тем не менее в
подавляющем большинстве реакций разбавленная
азотная кислота восстанавливается
преимущественно до NO.
В очень разбавленных растворах азотная кислота
проявляет окислительные свойства очень слабо и
только по отношению к сильным восстановителям
(магний, цинк, алюминий и подобные им металлы), при
этом в растворе образуются ионы аммония:
NO3 +
10H3O
+
10H3O + 8e–
= NH4
+ 8e–
= NH4 + 13H2O
или NO3
+ 13H2O
или NO3 + 10H
+ 10H + 8e– = NH4
+ 8e– = NH4 + 3H2O
+ 3H2O
Вопреки распространенному мнению, во многих
реакциях разбавленной азотной кислоты с
металлами среди прочих газов выделяется и
водород. Например, известно, что в реакциях с
магнием или марганцем он образуется в
количествах, вполне сопоставимых с количествами
других выделяющихся газов. Однако ни при каких
условиях водород не является единственным
продуктом восстановления азотной кислоты.
Рассмотрим примеры реакций.
Пример 1. Составьте уравнение реакции
концентрированной азотной кислоты с медью.
| 2 |
HNO3 + H3O + e– = NO2 + 2H2O + e– = NO2 + 2H2O |
| 1 |
Cu – 2e– = Cu2 |
Cu + 2HNO3 + 2H3O+ = Cu2 + 2NO2
+ 2NO2 + 4H2O
+ 4H2O
Так как источником ионов оксония является все
та же азотная кислота, то в молекулярном
уравнении записываем четыре молекулы HNO3,
из которых две восстанавливаются, а две образуют
нитратные ионы, идущие на связывание ионов меди.
Окончательно получаем:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 +
2H2O
+
2H2O
Пример 2. Составьте уравнение реакции
концентрированной азотной кислоты с мышьяком.
| 5 |
HNO3 + H3O + e– = NO2 + 2H2O + e– = NO2 + 2H2O |
| 1 |
As + 9H2O – 5e– = H3AsO4
+ 5H3O |
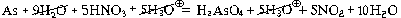
As + 5HNO3 = H3AsO4 + 5NO2 + H2O
+ H2O
В данном случае ионное уравнение совпадает с
молекулярным.
Аналогично, с образованием соответствующих
кислот, концентрированная азотная кислота
реагирует с другими неметаллами, проявляющими
восстановительные свойства (B, P, P4, S8 и
др.)
Пример 3. Составьте уравнение реакции
концентрированной азотной кислоты с сульфидом
железа(II).
| 9 |
HNO3 + H3O + e– = NO2 + 2H2O + e– = NO2 + 2H2O |
| 1 |
FeS + 12H2O – 9e– = Fe3 + SO42 + SO42 + 8H3O + 8H3O |
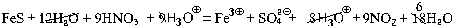
FeS + 9HNO3 + H3O+ = Fe3B + SO42A
+ 9NO2 + 6H2O
В молекулярном уравнении в этом случае будет
присутствовать Fe2(SO4)3, поэтому
для получения трех сульфат-ионов мы вынуждены
коэффициенты в уравнении утроить:
3FeS + 30HNO3 = Fe2(SO4)3 +
Fe(NO3)3 + 27NO2 + 15H2O
+ 15H2O
Пример 4. Составьте уравнение реакции
разбавленной азотной кислоты с железом.
| 1 |
NO3 + 4H3O + 4H3O + 3e– = NO + 6H2O
+ 3e– = NO + 6H2O |
| 1 |
Fe – 3e– = Fe3 |
Fe + NO3 + 4H3O+ = Fe3
+ 4H3O+ = Fe3 + NO + 6H2O
+ NO + 6H2O
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Как уже отмечалось, NO в этом случае – не
единственный продукт восстановления HNO3.
Пример 5. Составьте уравнение реакции
разбавленной азотной кислоты с сероводородом.
Концентрированная азотная кислота окисляет
газообразный сероводород (так же как и сульфиды)
до сульфат-ионов, а разбавленная – только до
серы:
| 2 |
NO3 + 4H3O + 4H3O + 3e– = NO + 6H2O
+ 3e– = NO + 6H2O |
| 3 |
H2S + 2H2O – 2e– = S +
2H3O |
2NO3 +
2H3O
+
2H3O + 3H2S =
2NO + 6H2O + 3S
+ 3H2S =
2NO + 6H2O + 3S
2HNO3 + 3H2S = 2NO + 4H2O + 3S
До серы окисляются разбавленной азотной
кислотой и сульфиды (как растворимые, так и
нерастворимые).
Пример 6. Составьте уравнение реакции,
протекающей при взаимодействии магния с очень
разбавленной азотной кислотой.
| 1 |
2 |
NO3 + 10H3O + 10H3O + 8e– = NH4
+ 8e– = NH4 + 13H2O
+ 13H2O |
| 4 |
8 |
Mg – 2e– = Mg2 |
4Mg + NO3 + 10H3O+ = 4Mg2
+ 10H3O+ = 4Mg2 + NH4
+ NH4 + 13H2O
+ 13H2O
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 +
3H2O
В отличие от азотной кислоты, в которой при
любых концентрациях атомами-окислителями
являются атомы азота, в серной кислоте атомы
серы являются окислителями только в
концентрированных растворах (и, конечно, в
безводной серной кислоте). Концентрированная
серная кислота – сильный окислитель, по
окислительной способности почти не уступающий
концентрированной азотной кислоте, а в некоторых
случаях даже превосходящий ее. Она реагирует,
почти со всеми восстановителями, с которыми
реагирует концентрированная азотная кислота.
Концентрированной серной кислотой, как и
азотной, часть металлов пассивируется.
Уравнение полуреакции восстановления серной
кислоты в концентрированном растворе:
H2SO4 + 2H3O + 2e– = SO2 + 4H2O или
H2SO4 + 2H
+ 2e– = SO2 + 4H2O или
H2SO4 + 2H +
2e– = SO2 + 2H2O
+
2e– = SO2 + 2H2O
В случае взаимодействия с сильными
восстановителями среди продуктов реакции могут
встречаться сера и сероводород, но они будут
образовываться только в случае бурно
протекающей реакции, сопровождающейся обильным
выделением газообразных продуктов. В обычных
условиях и сера, и сероводород успевают
прореагировать с концентрированной серной
кислотой, окисляясь до диоксида серы.
В разбавленных растворах и сульфат-ион, и
гидросульфат-ион окислительными свойствами (за
счет атомов серы) не обладают. Разбавленная
серная кислота окисляет только металлы, стоящие
в ряду напряжений левее водорода, то есть, она
ведет себя так же, как и другие кислоты-"
неокислители" (HCl, HBr, CH3COOH и т. п.).
Уравнение полуреакции в этом случае:
2H3O +
2e– = H2 + 2H2O или 2H
+
2e– = H2 + 2H2O или 2H + 2e– = H2
+ 2e– = H2
Рассмотренные нами особенности окислительной
активности азотной и серной кислот, в
зависимости от их концентрации иллюстрируют
общее правило: окислительные свойства
окислителей в концентрированных растворах
проявляются сильнее, чем в разбавленных. То же
относится и к растворам восстановителей.