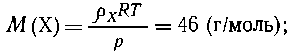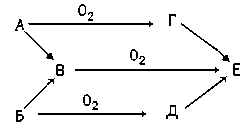Сорокин
В.В., Загорский В.В., Свитанько И.В.Задачи химических олимпиад.
§ 4. Определение формулы неизвестного вещества с использованием количественных данных
Чуть ли не половина всех химиков занимается
разнообразными методами количественного
анализа - экстракцией, хроматографией,
всевозможными видами спектроскопии, элементным
анализом, и безусловно вторая половина
пользуется этими методами как вспомогательными
для определения химического состава соединения.
Постараемся теоретически познакомить
интересующихся с тем, как из минимума
количественных данных можно получить максимум
информации о веществе.
Дополнительно к методам решений из предыдущих
разделов научимся решать задачи на определение
формулы неизвестного вещества.
"При сожжении т г органического вещества
получено т г диоксида углерода и т2 г
воды. Определить простейшую формулу
вещества".
Это - простейший пример такой задачи. Вот как ее
решать. Что такое простейшая (эмпирическая)
формула? Это атомные и соответственно мольные
соотношения составляющих элементов, т. е.
соотношение дробей, в числителе которых - масса
элемента, а в знаменателе - относительная атомная
масса.
В исходное органическое вещество могут входить
все составляющие продуктов сгорания: водород,
углерод, кислород.
| В 44 г СО2 содержится 12 г
углерода, |
| в m1 г CO2- -"- - - " - -
" х г -"- - - "- - " |
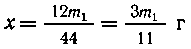
|
| В 18 г Н2О содержится 2 г
водорода, |
| В m2 г Н2О - "- -"-
- - "- у г - "- - - "- - " , |
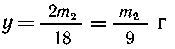
|
Масса кислорода равна (т-х-у) г, так как
другие элементы в продуктах сгорания
отсутствуют. Рассчитываем простейшую формулу:
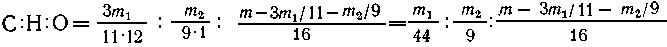
Формула вещества

В этом параграфе Вы встретите в качестве
составных частей рассматриваемого типа задач и
те, основные элементы которых мы уже разобрали в
предыдущих параграфах.
Пример 1. При взаимодействии оксида
некоторого металла с азотной кислотой
образовалось 34,0 г соли и 3,6 г воды. Какая масса
оксида металла, использованного для реакции?
Решение. Пусть формула соли A(NO3)n,
а оксида - А2Оn. Оксид растворяется в
азотной кислоте: А2Оn + 2n НNO3 = А
(NО3) п+ пН2О.
При образовании 1 моль ([М(А) + 62n] г) нитрата
одновременно образуется n/2 моль воды (9n
г):
(М(А)+62) г соли --------- 9n
г Н2О, |
34 г соли
------------------ 3,6 г Н2О. |
Отсюда 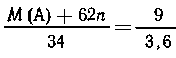 или М (А)
= 85-62n. Очевидно, что М(А)>0 только при п=1.
Значит,. М(А) = 23; это натрий. Оксид натрия
растворяется в азотной кислоте: Na2O + 2HNO3
= 2NaNO3+ H2O.
или М (А)
= 85-62n. Очевидно, что М(А)>0 только при п=1.
Значит,. М(А) = 23; это натрий. Оксид натрия
растворяется в азотной кислоте: Na2O + 2HNO3
= 2NaNO3+ H2O.
| При растворении 62 г Na2O
выделяется 18 г воды, |
| "------"-------"----- х г Na2O
"-------"------" 3,6 г - " - , |
|
x = 12,4г Na2O. |
Пример 2. При электролизе расплава 8 г
некоторого вещества на аноде выделилось 11,2 л
водорода (н. у.). Что это было за вещество? Можно ли
провести электролиз его водного раствора?
Решение. Выделившийся на аноде
водород содержался в веществе в виде Н-.
Значит, анализу подвергли гидрид: 2Н- - 2e = Н2o.
Водород объемом 11,2 л (н. у.) имеет массу 1 г, т. е. на 1
г водорода в гидриде приходится 7 г металла.
Отсюда атомная масса металла 7п, где п - количество
атомов водорода в гидриде. Существует 3 элемента
с массой , кратной 7: Li, Si, Fe. Кремний (n = 4)
отпадает, поскольку SiH4 не проводит
электрический ток, а степень окисления 8 (п=8,
М=56 г/моль) у железа в данном случае весьма
маловероятна. Следовательно, был взят гидрид
лития LiH. Электролиз водного раствора LiH провести
не удается из-за полного разложения последнего
водой:
LiH + H2O  LiOH + H2
LiOH + H2 .
.
Пример 3. При сжигании 23 г
газообразного вещества с плотностью р = 2,05 г/л при
н. у. получено 44 г диоксида углерода и 27 г воды.
Изобразите структурную формулу этого вещества.
Решение. Неизвестный газ - X. Согласно
закону для идеальных газов
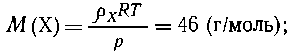
 (X) = 23/46 = 0,5 моль; (X) = 23/46 = 0,5 моль; |
 (CO2) = 44/44 = 1,0 моль; (CO2) = 44/44 = 1,0 моль; |
 (C) = l моль; m(С) = 12 г; (C) = l моль; m(С) = 12 г; |
 (H2O) = 27/18 = 1,5 моль; (H2O) = 27/18 = 1,5 моль; |
 (Н) = 3
моль; m (H) = 3 г. Соединение содержит также
кислород, поскольку m(C) + m(H) = 12 + 3 = 15 г
<23 г;
(Н) = 3
моль; m (H) = 3 г. Соединение содержит также
кислород, поскольку m(C) + m(H) = 12 + 3 = 15 г
<23 г;
m(О) = 23-15 = 8 г;  (O) = 5 моль;
(O) = 5 моль;  (C) :
(C) : (H) :
(H) : (O) = l : 3 : 0,5 = 2 : 6
: 1. Молекулярная формула соединения: С2Н6О.
Этой формуле отвечают 2 изомера: СН3СН2ОН
- этанол и СН3ОСН3 - диметиловый эфир,
но этанол при обычных условиях - жидкость, значит,
неизвестный газ - диметиловый эфир.
(O) = l : 3 : 0,5 = 2 : 6
: 1. Молекулярная формула соединения: С2Н6О.
Этой формуле отвечают 2 изомера: СН3СН2ОН
- этанол и СН3ОСН3 - диметиловый эфир,
но этанол при обычных условиях - жидкость, значит,
неизвестный газ - диметиловый эфир.
Задачи
1. При прокаливании 80 г безводного
сульфата трехвалентного элемента получается его
оксид массой на 24 г меньше молярной массы
элемента. Определите, какой это элемент. Ответ
2. При прокаливании 10,4 г сульфита
неизвестного металла получен его оксид такой же
массы, как при разложении 5,8 г его гидроксида.
Определите, сульфит какого металла был
подвергнут разложению.Ответ
3. Над раскаленными докрасна железными
опилками массой 16,8 г пропускали водяной пар. Все
опилки прореагировали полностью. Масса одного из
продуктов реакции - водорода - составила 0,8 г.
Определите формулу второго продукта реакции.Ответ
4. Простые вещества А и Б способны
реагировать между собой, образуя вещество В, а
также гореть на воздухе, образуя соответственно
вещества Г и Д. Продукты их сгорания реагируют
между собой, причем в отсутствие воды при реакции
веществ Г и Д получается только одно вещество Е,
которое может получаться также при окислении
вещества В. Предложите вещества А и Б, лучше всего
соответствующие условию данной задачи. Схема
реакций:
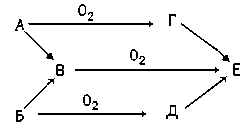
Ответ
5. Вещества А и Б бурно реагируют между
собой с образованием продукта В. При обработке В
оксидом углерода (IV) образуются вещества Б и Г (Г
содержит 8,14% углерода и 32,5% кислорода). Определите
вещества А-Г, напишите уравнения реакций.Ответ
6. Некоторый газ А, являющийся простым
веществом, реагирует с водородом в присутствии
катализатора, образуя вещество Б, которое можно в
несколько стадий превратить в бесцветную
жидкость В, обладающую кислотными свойствами.
При взаимодействии избытка Б с В образуется
белое твердое вещество Г, разлагающееся при
умеренном (~150oС) нагревании с выделением
газа Д. Газ Д реагирует с продуктом
взаимодействия Б и металлического натрия (Е),
образуя при этом соль Ж, хорошо растворимую в
воде и содержащую 64,6% азота. О каких веществах
идет речь? Напишите уравнения соответствующих
реакций.Ответ
7. Два образца белых порошков массой по
9,0 г растворили в воде, каждый в отдельной колбе.
При этом из колб выделилось по 22,4 л горючего газа
(н. у.). Анализ полученных водных растворов
показал, что они представляют собой растворы
одной и той же щелочи: 1,0000 моль в одной колбе и 1,0417
моль - в другой. Что представляют собой исходные
порошки? Объясните результаты эксперимента.Ответ
8. Смесь металла с его оксидом
полностью восстановили водородом, а продукт
реакции растворили в разбавленной серной
кислоте. Объем выделившегося при этом водорода
равен объему водорода, пошедшего на
восстановление исходной смеси (объемы измерены
при одинаковых условиях). Какие металлы и оксиды
удовлетворяют условию задачи? Приведите примеры
таких смесей, рассчитайте в этих примерах
молярные соотношения металла и его оксида.Ответ
9. При окислении смеси органических
соединений А и Б избытком подкисленного раствора
перманга-ната калия образуются оксид углерода (IV)
и белое кристаллическое вещество В, которое
превращается в бензол при нагревании с
гидроксидом натрия. Определите качественный и
количественный состав смеси А и Б, если известно,
что количество гидроксида натрия, необходимое и
достаточное для поглощения выделившегося при
окислении газа, равно 0,25 количества NaOH, пошедшего
на превращение в бензол вещества В. При реакции
исходной смеси с хлором на свету могут
образоваться только три монохлорпроизводных
углеводорода.Ответ
10. К раствору соли серебра (раствор 1)
прибавили: а) нитрат бария, произошла реакция,
выпал осадок 1, содержащий 46,2% бария; б) небольшой
объем раствора щелочи, осадка нет; в) воду, выпал
белый осадок 2, содержащий 57,4% серебра.
Объясните результаты эксперимента и определите
качественный состав раствора 1.Ответ
11. Через последовательно соединенные
электролизеры с инертными электродами,
содержащие: первый - раствор хлорида бария,
второй - раствор сульфида калия с одинаковыми
количествами веществ, пропускают электрический
ток. Электролиз прекратили, когда в первом
электролизере прекратилось повышение
концентрации гидроксильных ионов, а на аноде
этого электролизера выделилось 1,12 л газа.
Полученные в результате электролиза растворы
смешали. Определите состав и массу вы-лавшего
осадка.Ответ
12. Твердое вещество А массой 4 г
обработали хлором и получили единственный
продукт Б, жидкий при нормальных
условиях.Привнесении продукта Б в избыток воды
образуется 3 г исходного вещества А. Из
получившегося сильнокислого раствора при
нагревании выделяется газ В с плотностью по
воздуху 2,2. При окислении кислородом исходной
навески вещества А можно выделить в 4 раза больше
газа В, чем из раствора, полученного при внесении
Б в воду. Определите вещества А, Б, В.Ответ
13. При сжигании 1,792 л (н. у.) смеси
метана, оксида углерода(II) и кислорода в
калориметре выделилось 13,683 кДж теплоты. Если к
продуктам сгорания добавить некоторое
количество водорода и вновь поджечь, то
выделится дополнительно 9,672 кДж теплоты.
Известно, что при реакциях образования из
простых веществ 1 моль метана, оксида углерода (II),
оксида углерода (IV) и воды выделяется 74,8; 110,5; 393,5;
241,8 кДж теплоты соответственно. Каковы
парциальные объемы каждого из газов в исходной
смеси?Ответ
14. В колбе нагрели 0,18 г простого
вещества с избытком концентрированной серной
кислоты. Газообразные продукты реакции
пропустили в избыток раствора гидроксида
кальция, при этом выпало 5,1 г осадка Определите
исходное вещество А. Ответ подтвердите
соответствующими расчетами и уравнениями
реакцийОтвет
15. При нагревании навески некоторого
твердого вещества А образовалось 0,6 г твердого
вещества Б и газообразное вещество В Твердый
продукт разложения Б растворили в воде; при этом
образовался раствор, содержащий 0,96 г вещества Г.
Газообразный продукт разложения В пропустили
через избыток раствора вещества Д, в результате
чего образовалось 6,52 г вещества Е. При
взаимодействии последнего в водном растворе с
веществом Г образуются А и Д Определите, что
представляют собой вещества А, Б, В, Г, Д, Е.
Напишите уравнения соответствующих реакций.Ответ
16. При прибавлении к раствору нитрата
двухвалентного металла избытка карбоната натрия
выпадает 2,37 г осадка, а при прибавлении к тому же
количеству этого раствора избытка сульфата
натрия выпадает 2,80 г осадка. Определите, нитрат
какого металла был взят для анализа. Как
относится эта соль к нагреванию?Ответ
17. После взрыва смеси, состоящей из
одного объема исследуемого газа и одного объема
водорода, получился один объем водяного пара и
один объем азота. Все измерения проводились при
одинаковых условиях. Определите формулу
исследуемого газа Как можно получить этот газ в
лабораторных условиях?Ответ
18. При приливании раствора,
содержащего 1,02 г соли сероводородной кислоты к
раствору, содержащему 2,7 г хлорида
двухвалентного металла, выпало 1,92 г осадка Какие
соли взяты для проведения реакции, если они
прореагировали полностью?Ответ
19. Бесцветный газ (объемом 5,6 л) (н. у.) с
относительной молекулярной массой на 3,4% меньше,
чем относительная молекулярная масса воздуха,
сожгли в избытке кислорода. Продукты сгорания
пропустили через 10%-и раствор гидроксида натрия с
плотностью 1,1. При этом образовался раствор
кислой соли. Какой объем раствора щелочи был
взят, если известно, что продукты сгорания
исходного газа не содержат воду.Ответ
20. Соединение, образованное тремя
элементами массой 10,8 г, осторожно обработали
газообразным хлором. При этом получили смесь
двух хлоридов и хлороводород, из которого можно
получить 400 г соляной кислоты с массовой долей 7,3%.
Суммарная масса образовавшихся хлоридов - 38,4 г.
Определить формулу исходного соединения, если об
одном из элементов известно, что его массовая
доля в исходном веществе 42,6%, а в хлориде 39,3%.Ответ
21. Навеску алюминия массой 3,55 г внесли
в 100 мл раствора индивидуальной соли Hg^NOsb (х=1 или
2), концентрация которой 0,5 моль/л. После окончания
реакции взаимодействия алюминия с раствором
масса нерастворенных веществ составила 17,65 г.
Определите, какая соль ртути введена в реакцию.
Напишите уравнения происходящих процессов.Ответ
22. Неизвестный металл массой 13 г
обработали избытком разбавленного раствора
азотной кислоты. К полученному раствору добавили
избыток горячего раствора гидроксида калия; при
этом выделилось 1,12 л газа (измеренного при н. у.).
Какой металл был растворен в азотной кислоте?Ответ
23. В герметичный сосуд емкостью 6 л
поместили заполненный газом полиэтиленовый
пакет объемом 2 л. Пакет весил на воздухе 0,536 г.
(Объем и массу пакета определяли при 760 мм рт. ст. и
0oС.) Сосуд с пакетом продули чистым
кислородом и затем увеличили давление кислорода
в сосуде до 1013 мм рт. ст. (при 0oС) Пакет
подожгли раскаленной спиралью. После сжигания и
охлаждения до 0o С давление в сосуде
составило 825 мм рт. ст. Пакет сгорел полностью.
Внутри было обнаружено 0,804 г воды. Какой газ
срдержался в полиэтиленовом пакете? Объемом
полиэтилена, воды и давлением ее паров можно
пренебречь.Ответ
24. При пропускании избытка паров воды
над раскаленным веществом А получено 4 г твердого
продукта Б и 1,235 л газа В. Объем газа измеряли при
20o С и 740 мм рт. ст. Разбавленный водный
раствор исходного количества вещества А
способен поглотить 1,235 л газа В с образованием 8,4
г вещества Г. При выпаривании получившегося
раствора на кипящей водяной бане выделилось
такое же количество вещества А, какое было взято
для первой реакции. Все перечисленные вещества
растворимы в воде. Назовите вещества А, Б, В, Г и
напишите уравнения соответствующих реакций.Ответ
25. Соль А прокалили в токе
хлороводорода до окончания реакции. Полученные
летучие продукты (2,58 л при 350o С и 750 мм рт.
ст.) поглощаются водой с выделением большого
количества теплоты. Раствор летучих продуктов
реагирует с водным раствором твердого продукта
первой реакции Б, при этом получается 11,65 г
осадка, нерастворимого в азотной кислоте. То же
количество вещества Б дает с избытком раствора
сульфата серебра 26,00 г белого осадка. Часть этого
осадка растворяется в аммиачной воде. Сколько
соли А взяли для прокаливания? Напишите
уравнения реакций.Ответ
26. Некоторый углеводород при
взаимодействии с хлором может давать дихлорид
либо тетрахлорид. Отношение относительных
молекулярных масс ди-хлорида и тетрахлорида
равно 0,637. Какие возможные структуры может иметь
исходный углеводород?Ответ
27. Некоторое количество углеводорода
состава СnН2n-2 дает с избытком хлора
21,0 г тетрахлорида. То же количество углеводорода
с избытком брома дает 38,8 г тетрабромида. Выведите
молекулярную формулу этого углеводорода и
напишите его возможные структурные формулы.Ответ
28. При бромировании неизвестного
углеводорода получено только одно
бромпроизводное с плотностью по воздуху 5,207.
Выведите структурную формулу углеводорода.Ответ
29. При взаимодействии с металлическим
натрием 5 г жидкости А, перегоняющейся при
постоянной температуре (84,1oС), выделяется
0,622 л горючего газа Б. С нагретым металлическим
натрием газ Б образует солеобразное вещество В,
легко разлагающееся водой с выделением 1,244 л того
же газа Б. 5 г жидкости А обесцвечивает без
выделения газообразных продуктов сернокислый
раствор 8,243 г перманганата калия, при этом
выделяется белое вещество Г, легко возгоняющееся
при нагревании, а при прокаливании со щелочью
дающее бензол. О каких веществах идет речь?
Напишите уравнения упомянутых реакций.Ответ
30. К 50 г 35,6%-го раствора галогенида
щелочного металла прибавили 10 г раствора нитрата
серебра. После выпадения осадка концентрация
исходного галогенида уменьшилась в 1,2 раза. Какой
щелочной металл и какой галоген входили в его
состав? Определите формулу галогенида щелочного
металла.Ответ
31. Для полного сгорания некоторого
органического вещества потребовалось в 2 раза
меньше кислорода, чем для полного сгорания
следующего члена гомологического ряда. Какие это
могут быть соединения?Ответ
32. При гидролизе 7,42 г некоторого эфира
получено 3,22 г одноосновной карбоновой кислоты и
6,72 г одноатомного спирта. Какой эфир был взят для
гидролиза?Ответ
33. Газ А может быть получен реакцией
бинарного солеобразного вещества, содержащего
водород, с хлоридом ХС1з, элемента X. Газ этот
использует.-ся как ракетное топливо, так как
выделяет большое количество теплоты при
сжигании. Газ А обесцвечивает бромную воду; если
после этого раствор упарить досуха, в остатке
окажется единственное вещество Б - важный
фармакологический препарат. Эбуллиоскопическое
измерение (по повышению температуры кипения
раствора) относительной молекулярной массы Б
дало величину 62. Конденсат, собранный при
упаривании, содержит, кроме воды, также одно
вещество, дающее осадок с раствором нитрата
серебра. Массовая доля серебра в осадке 57,45%.
Определите, о каких веществах идет речь, свой
ответ логически обоснуйте. Как Вы считаете, могут
ли существовать другие соединения, включающие те
же элементы, что и А? Будет ли зависеть состав
продуктов реакции А с бромной водой от ее
концентрации? Плотность газа А 1,25 г/л (н. у).Ответ
34. Неизвестная соль X при нагревании до
250o С разлагается, образуя ряд газообразных
при этой температуре продуктов А, Б, В и Г каждого
по 1 моль на моль X. Как растворение в воде, так и
приведение смеси к нормальным условиям дает соль
Д, и остается неизменным газ Б, переходящий при
сжигании в газ В. Газ Б можно получить при
нагревании В с углем. При 20o С раствором
щелочи поглощаются как газ В, так и жидкость Г.
Как смесь, полученная при нагревании X, так и
вещества X и Д дают осадки с известковой водой. О
каких веществах идет речь? Написать уравнения
всех приведенных реакций.Ответ
35. Некоторая жидкость перегоняется в
интервале температур 34-40o С. Она мало
растворима в воде, не способна к реакции с
гидроксидом меди (П), очень медленно реагирует со
щелочью на холоду.
Навеску этой жидкости массой 1,0000 г сожгли,
получив при этом 0,9722 г воды, 0,1718 г хлорово-дорода
и 2,0030 г диоксида углерода.
Исследуемую жидкость поместили в колбу с
обратным холодильником и обработали горячим
раствором гидроксида натрия. Произошло
частичное растворение жидкости, что
сопровождалось выделением газа с резким запахом.
Оставшуюся нерастворенной часть жидкости
отделили и обработали концентрированным
раствором йодида водорода, в результате чего она
прореагировала с образованием йод-этана
Определите состав жидкости Используя все данные
задачи, покажите, однозначно ли ее решение. Ответ
обоснуйте Напишите уравнения реакций. Какое
вещество обусловливает появление резкого
запаха. Предположите механизм образования
йодэтанаОтвет



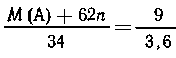 или М (А)
= 85-62n. Очевидно, что М(А)>0 только при п=1.
Значит,. М(А) = 23; это натрий. Оксид натрия
растворяется в азотной кислоте: Na2O + 2HNO3
= 2NaNO3+ H2O.
или М (А)
= 85-62n. Очевидно, что М(А)>0 только при п=1.
Значит,. М(А) = 23; это натрий. Оксид натрия
растворяется в азотной кислоте: Na2O + 2HNO3
= 2NaNO3+ H2O.