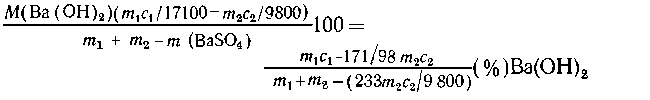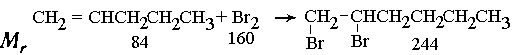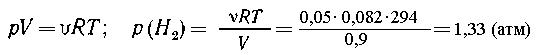Сорокин В.В.,
Загорский В.В., Свитанько И.В.Задачи химических
олимпиад.
2.2.2. Расчеты с учетом избытка одного из
реагентов
Во всех предыдущих задачах непременным
являлось одно из условий: либо одно из веществ (А
или В), реагирующих по уравнению aA + bB = cC + dD, находилось
в избытке, либо вещества были взяты в
эквивалентных количествах.
Как быть, если одновременно даны массы веществ
А и В: m(А) и m (В)? По какому из веществ вести расчет?
Совершенно очевидно, что расчет необходимо вести
по тому веществу, которое израсходуется
полностью, т. е. находится в недостатке; второе
вещество прореагирует частично и избыток его
останется.
Условие задачи можно сформулировать следующим
образом. "Смешали вещество А массой m(А) с
веществом В массой m(В); произошла реакция,
образовались вещества С и D. Требуется для
вещества С найти массу т(С)".
В общем виде предполагается следующее решение.
Количество вещества A:  (A) = m(A)/M(А) моль, а количество
вещества В:
(A) = m(A)/M(А) моль, а количество
вещества В:  (B)
= m(B)/M(B) моль. Согласно уравнению реакции а моль
вещества А реагирует с b моль вещества В, т. е.
если
(B)
= m(B)/M(B) моль. Согласно уравнению реакции а моль
вещества А реагирует с b моль вещества В, т. е.
если  (A)/
(A)/ (B)>a/b, то В
- в недостатке, а если
(B)>a/b, то В
- в недостатке, а если  (A) /
(A) /  (B)< a/b, то А — в недостатке.
(B)< a/b, то А — в недостатке.
Пример 1. К раствору,
содержащему 20 г гидроксида натрия, прибавили 70 г
30%-го раствора азотной кислоты. Какой цвет будет
иметь лакмус в полученном растворе?
Решение.
| NaOH |
+ HNO3 |
= NaNO3 + Н2О
|
| 1 моль |
1 моль |
|
20 г NaOH составляют 0,5 моль; 70 г 30%-го
раствора НМО3 содержит 70  0,3 = 21 (г) кислоты, что
составляет 0,33 моль. Таким образом, гидроксид
натрия содержится в избытке (0,5>0,33). Полученный
раствор будет иметь щелочную реакцию и лакмус
окрасится в синий цвет.
0,3 = 21 (г) кислоты, что
составляет 0,33 моль. Таким образом, гидроксид
натрия содержится в избытке (0,5>0,33). Полученный
раствор будет иметь щелочную реакцию и лакмус
окрасится в синий цвет.
Пример 2. Газообразный
предельный нециклический углеводород объемом 224
мл (н. у.) сожгли и продукты растворили в 1 л 0,148 %-й
известковой воды (плотность 1,0 г/мл). При этом было
получено 1,0 г осадка. Определите молекулярную
формулу углеводорода.
Решение. Уравнения
происходящих реакций:
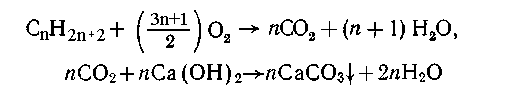
Раствор известковой воды содержал 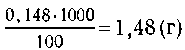 или
или 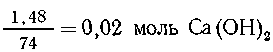
Осадок -1,0 г СаСОз составляет 1,0/100 = 0,01 (моль) СаСО3.
Предполагаем два варианта решения задачи:
1) Са(ОН)2 - в избытке,
тогда на осаждение СаСО3 потребовалось 0,01
моль СО2, т. е. v(CO2) = 0,01 моль, а СnН2n+2
также взято 0,224/22,4 = 0,01 моль, следовательно n=1; СnН2n+2
— метан: СН4;
2) Са(ОН)2 - в недостатке,
когда осадок массой 0,1 г является результатом
двух реакций - осаждения и частичного
растворения по уравнению nСаСО3 + nСО2
+ nН2О = nСа(НСО3)2
При осаждении получается 0,02 моль СаСО3,
остается 0,01 моль СаСО3, т. е. 0,01 моль СаСО3
вступило в последнюю реакцию. Рассчитаем
количество СO2:
а) для осаждения:
|
kCO2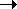 |
kCa (OH)2 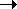 |
kCaCO3 |
| v |
x |
0,02 моль |
0,02 моль; |
|
|
x = 0,02 моль; |
|
б) для растворения:
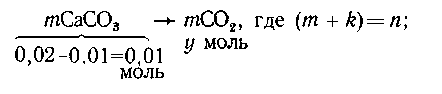
y = 0,01 моль
| Всего nСО2 |
- 0,03 моль, |
| CnH2n+2 |
- CO2, |
| 0,01 моль |
0,03 моль |
| n =3, т. e. пропан (С3Н8). |
Задачи
1. Какая минимальная масса (г)
кислорода необходима для полного сгорания 32 г
серы? Выберите правильный ответ:
а ) 16; б) 22; в) 28; г) 32.
2. В качестве азотных удобрений можно
применять нитрат аммония NH4NO3 и
карбамид (NH2)2CO. 1 кг карбамида стоит а
рублей, а 1 кг нитрата аммония - b рублей,
причем а>b. Считая, что растения усваивают
азот полностью, определите, при каком
соотношении а : b применение нитрата аммония
станет более выгодным.
3. Оксид меди (II) массой 8 г обработали 20
мл 4,9%-го раствора серной кислоты (плотность 1,03
г/см3). Полученный раствор отфильтровали,
фильтрат упарили при 100o С. Какое вещество
было получено? Какова его масса?
4. Какой объем (л) оксида углерода (IV),
измеренный при н. у., выделится при
взаимодействии 1,8 г гидрокарбоната калия с 65 г
10%-и серной кислоты?
5. Смесь аммиака и кислорода объемом 28
л прореагировала в присутствии катализатора.
После реакции осталось б л кислорода. Определите
состав исходной смеси. Измерения проводились при
одинаковых условиях.
6. Определите массовую долю (в
процентах) вещества в растворе, полученном при
сливании mi г раствора гидроксида бария с
массовой долей с1 (%) и m2 г раствора
серной кислоты с массовой долей c2 (%).
7. Какую массу (г) бертолетовой соли
надо разложить термически, чтобы полученного
кислорода хватило для полного сгорания 18 г
глюкозы. Какой объем будет занимать газообразный
продукт сгорания глюкозы при нормальных
условиях?
8. Гексен-1 массой 8,4 г смешали со 120 г
10%-го раствора брома в тетрахлориде углерода.
Определите количественный состав полученного
раствора.
9. В однолитровую склянку, содержащую
100 мл 10%-й соляной кислоты, при t = 21o С было
помещено 3,25 г цинка, после чего склянка была
тотчас закупорена. Какое давление установится в
склянке после окончания реакции, если
температура не меняется (плотность кислоты
принять равной 1 г/см3, начальное давление ро
= 1 атм, а изменением объема жидкости и твердого
вещества можно пренебречь).
Решения
| 1. |
S + |
02 |
=SO2. |
Ответ: г) 32 г. |
| Mr |
32 |
32 |
|
|
2. Применение нитрата аммония будет
экономически оправданным тогда, когда часть
стоимости, приходящейся на содержащийся в нем 1
кг азота, меньше стоимости 1 кг азота из (NH2)2CO.
Стоимость 1 кг азота из нитрата аммония равна
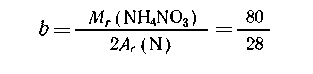
Стоимость 1 кг азота, содержащегося в карбамиде,
равна
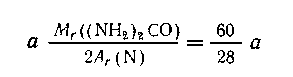
Применение нитрата аммония становится более
выгодным при соотношении
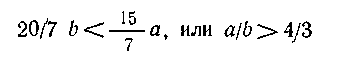
3.CuO + H2SO4 = CuSO4 + H2O
8 г СuО составляют 8/80 = 0,1 моль, 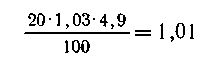 H2SO4 составляют
0,0103 моль.
H2SO4 составляют
0,0103 моль.
Таким образом, серная кислота содержится в
недостатке. Было получено 0,0103 моль CuSO4. При
упаривании образовался медный купорос: CuSO4 5H2O
массой 0,0103
5H2O
массой 0,0103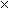 (160+90)
=2,575 (г).
(160+90)
=2,575 (г).
4. H2SO4 + KHCO3 = KHSO4 +
CO2 +H2O.
+H2O.
1,8 г KHCO3 составляют 1,8/100 = 0,018 моль,
65 г 10%-й H2SO4 содержат 6,5 г кислоты, что
составляет 0,066 моль. Таким образом, гидрокарбонат
калия находится в недостатке. Из 0,018 моль KHCO3
получится 0,018 моль СО2, что при н. у.
соответствует 22,4-0,018 = 0,4 (л).
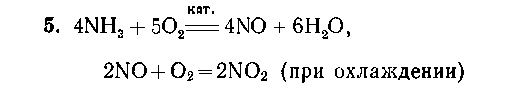
суммарное уравнение реакции: 4NH3 + 7O2  4NO2
+ 6Н2О. Осталось 6 л, значит в реакцию
вступило 28-6 = 22 л смеси, причем объемы
прореагировавших NH3 и О2 относятся
как 4 : 7. Таким образом, в реакцию вступило 8 л NH3
и 14 л О2. Исходная смесь содержит 8 л аммиака
и 20 л кислорода.
4NO2
+ 6Н2О. Осталось 6 л, значит в реакцию
вступило 28-6 = 22 л смеси, причем объемы
прореагировавших NH3 и О2 относятся
как 4 : 7. Таким образом, в реакцию вступило 8 л NH3
и 14 л О2. Исходная смесь содержит 8 л аммиака
и 20 л кислорода.
6. Уравнение реакции:
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O.
В m1 г раствора Ва (ОН)2
находится 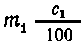 или
или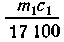 моль основания. В растворе H2SO4
находится
моль основания. В растворе H2SO4
находится
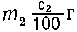 ,
или
,
или 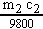 моль кислоты. Если
моль кислоты. Если 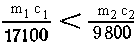 , то в растворе
останется
, то в растворе
останется
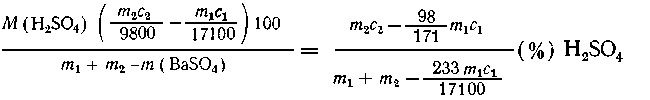 .
.
Если 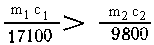 ,
то в растворе останется Ва(ОН)2:
,
то в растворе останется Ва(ОН)2:
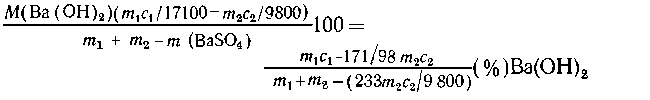
7. С6Н12O6 + 6O2 = 6СO2
+ 6Н2О
|
|
x л |
|
|
|
С6Н12O6 + |
6O2 = |
6СO2 + |
6Н2О |
| Мг |
180 |
|
|
|
|
|
180 г--- |
6 22,4 л 22,4 л |
|
|
|
18 г---- |
х л, |
|
|
x = 6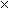 22,4 = 13,44 л О2 22,4 = 13,44 л О2 |
Газообразным продуктом при н. у. будет только
оксид углерода(IV), объем его равен объему
прореагировавшего кислорода - 13,44 л.
|
МnО2 |
|
|
2КСlО3 |
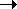
|
2КСl + |
3O2 |
2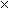 122,5 122,5 |
|
|
3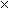 22,4 л 22,4 л |
x г |
------ |
------- |
13,44 л |
|
x = 49 г. |
8.
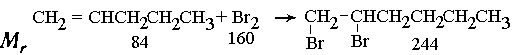
8,4 г гексена-1 составляют 0,1 моль, 120 г 10%-го
раствора Вr2 содержат 120-0,1 = 12 г Вr2, или
0,075 моль.
Таким образом, гексен-1 содержится в избытке. Было
получено 0,075 моль продукта присоединения. Масса
полученного 1,2-дибромгексана составляет: 244-0,075 =
18,3 г.
9. Zn+2HCl = ZnCl2 + H2t;
| на 65 г Zn требуется 2-36,5 г кислоты, |
| на 3,25 г Zn — ” — х г — ” — , |
| д; = 3,65 г НС1. |
Раствор содержит 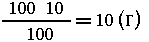 НСl,
т. е. кислота в избытке. 3,25 г Zn составляют 0,05 моль.
Таким образом, выделится 0,05 моль Н2.
НСl,
т. е. кислота в избытке. 3,25 г Zn составляют 0,05 моль.
Таким образом, выделится 0,05 моль Н2.
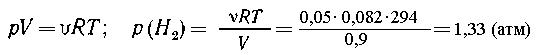
Общее давление в склянке после реакции: 1 + 1,33 =
2,33 атм.


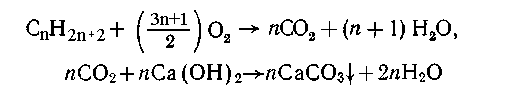
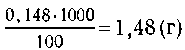 или
или 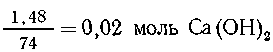
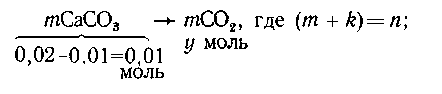
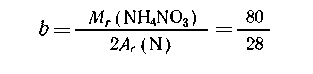
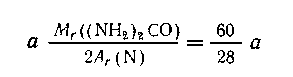
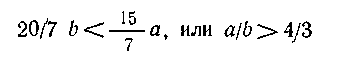
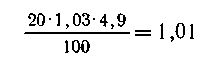 H2SO4 составляют
0,0103 моль.
H2SO4 составляют
0,0103 моль.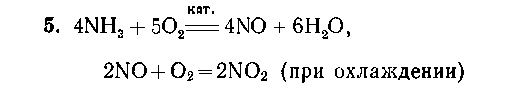
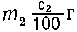 ,
или
,
или 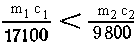 , то в растворе
останется
, то в растворе
останется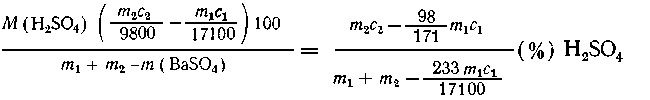 .
.