|
VIII. Физика химических реакций
Химия, как всякая высокоразвитая
наука, стала наукой высокого риска - в том смысле,
что ее задачи сложны и не всегда могут быть
решены современными методами, поэтому в научном
поиске высока степень неудач, бесплодных затрат
труда, времени и средств. Снизить степень риска
можно лишь на основе глубокого понимания физики
химических реакций - наиболее важной и элитарной
части химической физики.
В основе физики химических реакций
лежат четыре динамики:
- молекулярная динамика и молекулярная
организация;
- энергетическая динамика (энергетическая
динамика в газах, миграция энергии в кластерах,
трансформация энергии в жидкостях,
энергетическая релаксация в твердых телах);
- химическая динамика (поверхности потенциальной
энергии, энергетика в химической динамике,
теория химических реакций);
- динамика углового момента и спиновая динамика.
Физика химических реакций -
экспериментально-теоретическая наука, успехи ее
закономерны, проблемы традиционно ясны (их
анализ дан в работе24). На острие этой науки
находится химическая динамика и ее главная часть
- теория химических реакций.
Химическая динамика выросла из
химической кинетики, которая в настоящее время
является общехимической наукой: она вошла во все
разделы химии и способствовала разработке
универсальных кинетических критериев
механизмов реакций.
Однако если химическая кинетика
измеряет число химических событий, т.е. время
между ними, то химическая динамика измеряет
время самого события - движения реагентов по
поверхности потенциальной энергии. И это
центральное событие, вокруг которого обращается
вся химия и которое составляет сердце химической
реакции. Химическая динамика есть кардиограмма
этого "химического" сердца.
Успехи теории химических реакций -
особая богатая тема.67,68 Фактически
она призвана решать две крупные задачи:
построение поверхностей потенциальной энергии и
расчет движения ядер реагентов в рассчитанных
потенциальных полях (собственно динамика
химического акта).
Обе задачи решаются в разных
вариантах, на разных уровнях приближений, с
разной степенью учета квантовости движения. В
принципе сегодня для любой реакции можно
построить потенциальные поверхности с любой
степенью точности (при этом необходимо уметь
сколь угодно сложную реакцию сводить к простой
без потери физического и химического содержания
с учетом возможностей современной
вычислительной техники). Разработаны надежные
методы расчета динамических траекторий движения
реагентов на потенциальных поверхностях: метод
классических траекторий (по законам
классической механики
Гамильтона-Ньютона-Лагранжа), полуклассических
(учет квантовых эффектов через суперпозицию
начальных квантовых состояний реагентов) и чисто
квантовых траекторий (из решений уравнения
Шредингера с получением вероятностей
превращения реагентов по всем каналам -
Д-матрицы, или матрицы рассеяния). Из
совокупности траекторий рассчитываются
константы скорости - канонические k(T) и
микроканонические k(E), где Т и Е -
температура и энергия. Два примера таких
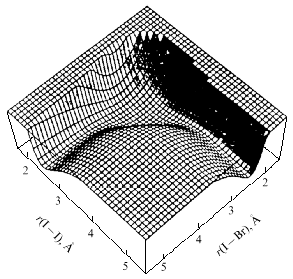
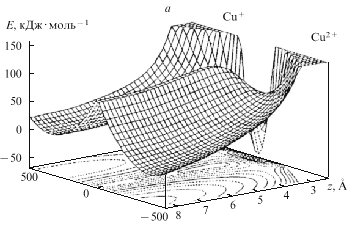
расчетов показаны на рис. 14 и 15.
 |
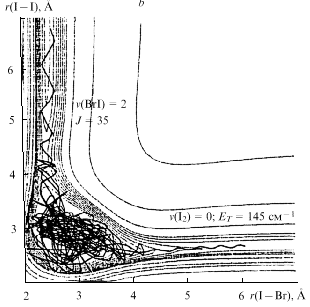 |
Рис. 14. Поверхность потенциальной
энергии реакции Br + I2  BrI + I
(а) и одна из траекторий на этой поверхности (b) с длительностью
17.6 пс BrI + I
(а) и одна из траекторий на этой поверхности (b) с длительностью
17.6 пс
 - колебательные состояния, J -
вращательный момент, ЕT - кинетическая
энергия - колебательные состояния, J -
вращательный момент, ЕT - кинетическая
энергия |
 |
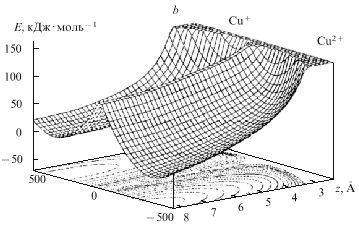 |
Рис. 15. Поверхности свободной энергии
реакции Cu2+ Cu+ на
электроде при адиабатическом (а) и
неадиабатическом (b) превращении, z - расстояние
иона от электрода, Е - энергия реорганизации
растворителя Cu+ на
электроде при адиабатическом (а) и
неадиабатическом (b) превращении, z - расстояние
иона от электрода, Е - энергия реорганизации
растворителя |
Разработаны общие методы решения
динамической задачи - метод гамильтониана пути
реакции, метод кривизны траектории, квантовая
многомерная динамика, квантовая теория
переходного состояния. Главная идея
динамических методов - выделить движение
реагентов вдоль координаты реакции и учесть
влияние всех других движений - и
"ассистирующих", и тормозящих.
Взаимодействие всех типов движения - вдоль
координаты и прочих - рассматривается как
"динамическое трение" и его расчет - одна из
забот современной теории
Однако у теоретического могущества
химии есть одна неприятная сторона Широкое и
успешное применение методов квантовой химии,
методов молекулярной динамики стимулирует
прогрессирующую болезнь - уход от наукоемкого и
дорогого эксперимента Это - объективная
реальность и общая тенденция движения мировой
химии (воз можно, не только химии)
Есть глубокое родство между теорией
химических и ядерных реакций (причем не только в
диффузионном режиме, где кинетические уравнения
и их решения абсолютно тождественны) Химически
реагирующая система в жидкости или твердом теле
подобна реагирующим нуклонам в окружении среды -
других нуклонов ядра. И здесь у химии
положение выгодное - в ней есть простота, которая
выражается в том, что работает только одно
взаимодействие - кулоновское, с известной
зависимостью энергии от расстояния Это
утверждение фундаментального свойства оно
следует из квантовой механики (законы которой
также неоспоримо точны, как и законы
классической механики) Но оно имеет и прямые
экспериментальные доказательства Речь идет об
экспериментальном зондировании атомных
волновых функций, на которых стоит вся химия
Эксперимент этот очень прост: атомный
пучок (Са или Сu) возбуждается поляризованным
светом в состояния pz или dz2 ,
далее на этот пучок с ориентированными в
пространстве орбиталями pz и dz2
направляется скрещенный пучок атомов Не,
рассеяние которого детектируется, а затем по
картине рассеяния восстанавливается
рассеивающий потенциал Результат оказался очень
наглядным профиль рассеяния точно воспроизводит
форму атомных орбиталей
Конечно, можно сказать, что это
банальный результат (в том смысле, что другой и не
ожидался), но он дает глубокое понимание того, что
в химии работает только кулоновский потенциал
(часть которого - обменное взаимодействие -
зависит от спина) Но если вспомнить, что атомные
волновые функции получены на кончике пера из
постулатов квантовой механики и уравнения
Шредингера с центрально симметричным
кулоновским потенциалом, то появляется
осознание торжества человеческой мысли
Волшебство химии и ее очарование
состоят в том, что из кулоновского потенциала
рождается богатство химических связей (ионных,
ковалентных, донорно-акцепторных, дативных,
водородных, ван-дер-ваальсовых), химических
частиц (атомы, карбены, ионы, молекулы,
эксиплексы, ридберги, эксимеры, ван-дер-ваальсовы
молекулы, комплексы, радикалы и др), состояний
(основных, возбужденных, зарядовых, спиновых,
орбитальных, различных по симметрии и т д),
механизмов химических превращений и управляющих
факторов (энергия, спин, фаза, орбитальная
симметрия). В этом многообразии и богатстве химия
всегда нова. Примером может служить открытие
новых состояний молекул водорода (рис. 16).
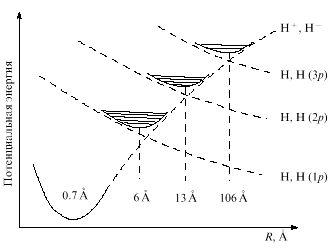 |
Рис. 16.Схема термов метастабильных
молекул водорода с межатомными расстояниями 6, 13
и 106 А. Они располагаются в адиабатических
долинах на пересечениях ионного терма (Н+/Н)
с термами, соответствующими орбитально
возбужденным состояниям Н (1р), Н(2р) и Н(Зр).
|
Им соответствуют минимумы
адиабатических потенциальных кривых,
расположенные в окрестностях точек пересечения
связывающего терма Н+ + Н-(1s2) и
отталкивательных термов H(ls) + Н(пр), где п =
1, 2, 3,.... Это не ридберговские молекулы, у которых
"пухлая" электронная оболочка с главными
квантовыми числами, достигающими сотен, а
"нормальные" молекулы с равновесными
межатомными расстояниями б, 13, 106 А и т.д. со своими
колебательно-вращательными спектрами.
Аналогичные молекулы могут существовать и в
случае других атомов. Их можно обнаружить в
низкотемпературной и разреженной плазме или в
межзвездном гигантском химическом реакторе.
|





