Решения
V Соросовская Олимпиада. Химия, III тур, 10 класс
II-10-1.1. Обесцвечивание раствора связано с образованием устойчивого бесцветного комплекса Na3FeF6:
FeCl3 + 6NaF ![]() Na3FeF6 + 3NaCl
Na3FeF6 + 3NaCl
Появление голубой окраски объясняется образованием оксида азота N2O3:
0 oC |
| NaNO2 + HCl |
2[HNO2] ![]() N2O3
+ H2O
N2O3
+ H2O
3. Кетоны в нейтральной среде устойчивы к окислению. В щелочном растворе за счет обратимой енолизации кетоны окисляются, а ион MnO4– восстанавливается до иона МnO42–, имеющего зеленую окраску:
K2CO3 + H2O![]()
![]() KOH + KHCO3
KOH + KHCO3
CH3COCH3 ![]() CH3C(OH)=CH2
CH3C(OH)=CH2
CH3COCH3 + 2KMnO4 + 2K2CO3
+ H2O ![]() CH3COCH2OH + 2K2MnO4 + 2KHCO3
CH3COCH2OH + 2K2MnO4 + 2KHCO3
(возможно более глубокое окисление)
III-10-2. а) Соль Мора (NH4)2Fe(SO4)2?6H2 O в растворах несколько более устойчива к окислению кислородом воздуха, чем сульфат железа (II), поэтому этот реактив используют в аналитической химии для установления титров, например:
10(NH4)2Fe(SO4)2 + 2KMnO4 +8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 10(NH4)2SO4 + 8H2O
б) Кислота Каро – мононадсерная кислота H2SO5. Ее растворы образуются при взаимодействии серной кислоты и пероксида водорода:
H2SO4 + H2O2 ![]() H2SO5
+ H2O
H2SO5
+ H2O
в) Основания Шиффа (азометины) - продукты конденсации карбонильных соединений (альдегидов и кетонов) с первичными аминами:
C6H5CHO + C6H5NH2
![]() C6H5CH=NC6H5
C6H5CH=NC6H5
г) Углеводород Чичибабина – тетрафенилдифенохинодиметан – углеводород цвета раствора перманганата, взаимодействует с кислородом воздуха, образуя перекись и при этом обесцвечивается. Он был получен А.Е.Чичибабиным в 1907 году, а его строение окончательно было установлено только в1952 году Г.В.Уэландом:

Это вещество получают путем отщепления хлора от соединения

под действием цинка.
д) Кетон Михлера [4-(CH3)2NC6H4]2 CO получается при реакции диметиланилина с фосгеном и широко используется при синтезе красителей трифенилметанового ряда:
(CH3)2NC6H5 + COCl2
![]() [4-(CH3)2NC6H4]2CO
+ 2HCl
[4-(CH3)2NC6H4]2CO
+ 2HCl
III-10-3. 1. На один атом углерода в
соединении Б приходится 12![]() 89,2/10,8 = 99,11 единиц атомной массы Cl,
Br и, возможно, водорода. Уравнение х + 35,5y +
80z = 99,11 не имеет целочисленных решений. Если в
молекулы А и Б входит четное число атомов
углерода, то при двух атомах углерода уравнение
имеет вид х + 35,5y + 80z = 198,22. Это
уравнение имеет целочисленное решение: x = 3, y
= 1, z= 2, тогда формула Б равна C2H3ClBr2
, и это соединение было получено из А по
следующему уравнению:
89,2/10,8 = 99,11 единиц атомной массы Cl,
Br и, возможно, водорода. Уравнение х + 35,5y +
80z = 99,11 не имеет целочисленных решений. Если в
молекулы А и Б входит четное число атомов
углерода, то при двух атомах углерода уравнение
имеет вид х + 35,5y + 80z = 198,22. Это
уравнение имеет целочисленное решение: x = 3, y
= 1, z= 2, тогда формула Б равна C2H3ClBr2
, и это соединение было получено из А по
следующему уравнению:
CH2=CHCl + Br2 ![]() BrCH2CHClBr.
BrCH2CHClBr.
2. При взаимодействии А с избытком хлорной воды в растворе будет находиться хлоральгидрат (продукт присоединения воды к трихлоруксусному альдегиду), образующийся в результате следующих реакций:
CH2=CHCl + Cl2 +H2O ![]() [CH2ClCH(OH)Cl]
[CH2ClCH(OH)Cl] ![]() CH2ClCHO
CH2ClCHO ![]() CCl3CHO
CCl3CHO ![]() CCl3CH(OH)2
CCl3CH(OH)2
III-10-4. Соединение Y, помимо С и Н, может содержать хлор и кислород. Если оно содержит кислород и не содержит хлора, то при соотношении С : Н : О = 79,22/12 : 5,7/1 : 15,08/16 = 7 : 6 : 1 его простейшая формула – С7 Н6О (для хлорсодержащего производного целочисленных соотношений атомов получить не удается). Сильная ненасыщенность соединения указывает на его принадлежность к ароматическому ряду. Но оно не является, например, бензальдегидом С6Н5 СНО (судя по методу получения). Если предположить, что исходный углеводород содержит семь атомов углерода, то три хлорпроизводных легко могут быть получены при хлорировании толуола:
Содержание хлора в смеси этих трех соединений действительно укладывается в интервал 28.1-54.5%
Cl2, h |
||||||
| C6H5CH3 | C6H5CH2Cl | C6H5CHCl2 | C6H5CCl3 | |||
| A, 28,03% Cl | B, 44,07%Cl | C, 54,44% Cl |
Это предположение также согласуется с результатами гидролиза реакционной смеси раствором гидрокарбоната калия:
| C6H5CH2Cl + КHCO 3 |
C6H5CH2OH |
+ KCl + CO2 |
D |
||
| C6H5CHCl2 + 2KHCO3 |
C6H5CHO |
+ 2KCl + 2CO2 + H2O |
F |
||
| C6H5CCl3 + 4KHCO3 |
C6H5COOK |
+ 3KCl + 4CO2 + 2H2O |
E |
При действии 30%-ного раствора КОН хлористый бензил А и бензотрихлорид С также дают бензиловый спирт D и бензоат калия Е, а промежуточно образующийся из бензилидендихлорида В бензальдегид F в этих условиях превращается в смесь D и E(реакция Канниццаро):
| 2C6H5 CHO + КОН |
C6H5CH2OH |
+ C6H5COOK |
D |
E |
Взаимодействие D и E с концентрированной серной кислотой приводит к образованию бензилбензоата (С14Н12О2 , простейшая формула С7Н6О):
| C6H5COOK + C6H5CH2OH
+ H2SO4 |
C6H5COOCH2C6H5 + | KHSO4 + H2O |
Y |
III-10-5. 1. Различное действие одного и того же раствора глюкозы связано с различной концентрацией веществ внутриклеточной жидкости в разных тканях организма и определяется осмотическим давлением. Если два раствора разной концентрации разделены полупроницаемой перегородкой (клеточной мембраной), вследствие разницы в осмотическом давлении по обе стороны мембраны происходит осмотическое всасывание из раствора с более низкой концентрацией в раствор повышенной концентрации, приводя к уменьшению разницы в концентрации. При этом осуществляется перенос низкомолекулярных питательных веществ. Осмотическое давление плазмы крови примерно соответствует изотоническому раствору (0,85-0,9%-ный раствор NaCl иди 4,5-5%-ный раствор глюкозы). При внутривенном вливании 20%-ный раствор глюкозы сильно разбавляется жидкостью крови и появляется возможность переноса глюкозы в клеточную ткань. На слизистой оболочке роговицы глаза в контакте с 20%-ным раствором глюкозы происходит перенос жидкости из отечной роговицы на внешнюю поверхность. Этот процесс напоминает засыхание растений на засоленных почвах.
2. Раствор глюкозы можно заменить раствором сахарозы при снятии отеков. Для улучшения питания тканей этот раствор непригоден, т.к. в крови отсутствуют ферменты, расщепляющие сахарозу до моносахаридов, обеспечивающих внутриклеточное питание.
III-10-6.
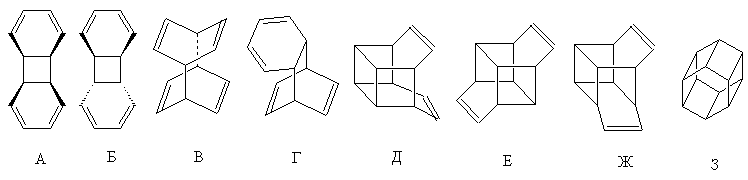
Число продуктов бромирования (без учета стереоизомеров): Г – четыре (два – при бромировании несопряженных связей, 1,2- и 1,4-присоединение при атаке по диеновой системе); А и Б – по два (1,2- и 1,4-присоединение); В, Д, Е, Ж – по одному; З – ноль (нет присоединения). Всего – 12 продуктов.
III-10-7. а) Существует 6 метильных производных этилена:

В метильных группах под влиянием ненасыщенного атома углерода в sp2-гибридизации увеличивается поляризация С-H связей, и группа СН3 обладает положительным (донорным) индуктивным эффектом. При этом под влиянием СН3 групп возрастает электронная плотность на кратной связи, и легко поляризуемая p -связь смещается в сторону атома, несущего наименьшее число СН3-групп
![]()
б) Симметричные молекулы А, E и G не
будут обладать дипольным моментом (симметричные
транс-изомеры дипольным моментом не обладают).
Суммирование влияния групп СН3 на смещение
электронной плотности позволяет оценить
полярность связи в несимметричных производных: C
>D > F ![]() B.
B.
в) Легкость присоединения по двойной связи определяется электронной плотностью на двойной связи и стабильностью промежуточно образующихся карбокатионов. Отсюда можно предположить, что скорость присоединения будет уменьшаться в ряду:
G > F> C> D ![]() E>B > A.
E>B > A.
III-10-8. Правило Марковникова определяет наиболее вероятное направление присоединения несимметричных реагентов (HCl, HBr, H2O) к непредельным соединениям
|
||
| CH3 |
= |
CH2 + HCl |
а) Правило Зайцева определяет строение непредельного соединения, образующегося при отщеплении галогеноводородов от галогеноуглеводородов и воды от спиртов: в этих реакциях образуется наиболее замещенный (богатый радикалами) алкен:
| KOH (спирт.р-р) | ||
| СH3CH2CHBrCH3 |
|
CH3CH=CHCH3 |
б) Согласно правилу Эльтекова-Эрленмейера соединения с гидроксильной или аминогруппой при кратной связи, а также соединения с двумя гетероатомами у одного атома углерода (две группы ОН, ОН и Сl, ОН и NH2, NH2 и Cl) (кроме двух атомов галогена), как правило, неустойчивы и либо изомеризуются:
[CH2=CHOH] ![]() CH3CH=O,
CH3CH=O,
либо отщепляют простейшие неорганические соединения (Н2О, HНal) с образованием соединений, содержащих связи С=Х:
[CH3CH(OH)2] ![]() CH3CH=O
CH3CH=O
в) Правило Хунда (Гунда) определяет последовательность заполнения электронами атомных орбиталей: в невозбужденном состоянии атом имеет максимально возможное число неспаренных электронов в пределах одной подоболочки. Так, в атоме углерода два 2p- электрона занимают две разные орбитали.
г) По правилу Хюккеля ароматическими являются плоские замкнутые (циклические) системы сопряженных связей, включающие 4n+2 p -электронов. Так, ароматический характер имеют бензол, нафталин. Системы циклобутадиена и циклооктатетраена не обладают ароматичностью.
III-10-9. Установим по данным анализа
простейшие формулы соединений A2, B2, A3, B3
. Соединения A2 и B2 содержат 15,4% кислорода.
Для формулы СxHyO молекулярная масса
составляет М=16/0,154=104 и из уравнения 12x + y + 16
= 104 следует, что x = 7, y = 4, то есть
простейшая формула A2 и B2 равна С7Н4
О. Оба соединения при окислении превращаются в
кислоты A3 (СаНвО2)n и B3
(СmHnO2)k . На один моль групп
COOH при титровании расходуется один моль щелочи.
Для кислоты A3 масса моля эквивалентов Е(A3)
= 1/(0,066![]() 0,125) =
121. И при формуле СаНвО2 решение
уравнения 12а + в + 32 = 121 дает: а = 7, в =
5, то есть A3 имеет простейшую формулу С7
Н5 О2 . Аналогично для кислоты B3
масса моля эквивалентов Е(B3) = 1/(0,096.
0,125) = 83 и решение уравнения 12m + n + 32 = 83 дает m
= 4, n = 3 и B3 имеет простейшую формулу С4
Н3 О2 . Существование кислот с
нечетным числом атомов водорода невозможно,
поэтому простейшие формулы кислот A3 и B3
должны быть по меньшей мере удвоены: A3 – С14
Н10 О4 и B3 – С8 Н6 О4
. Очевидно, что и для A2-B2 следует принять
как минимум удвоенную формулу: С14 Н8 О2
. Таким образом, соединения A2, B2, A3, B3
формально сильно ненасыщенны и их относительная
устойчивость в реакциях окисления может быть
объяснена наличием в структуре ароматических
группировок. Из полученных данных следует, что
при окислении A2 в A3 происходит изменение
состава на две ОН-группы, т.е. происходит разрыв
связи С-С с образованием двух карбоксильных
групп, а при окислении B2 в B3 происходит
отщепление шести атомов углерода, т.е. отгорание
одного бензольного ядра. Тогда B3 может иметь
структуру фталевой кислоты, полученной
окислением антрахинона B2 , и углеводород B1
является антраценом.
0,125) =
121. И при формуле СаНвО2 решение
уравнения 12а + в + 32 = 121 дает: а = 7, в =
5, то есть A3 имеет простейшую формулу С7
Н5 О2 . Аналогично для кислоты B3
масса моля эквивалентов Е(B3) = 1/(0,096.
0,125) = 83 и решение уравнения 12m + n + 32 = 83 дает m
= 4, n = 3 и B3 имеет простейшую формулу С4
Н3 О2 . Существование кислот с
нечетным числом атомов водорода невозможно,
поэтому простейшие формулы кислот A3 и B3
должны быть по меньшей мере удвоены: A3 – С14
Н10 О4 и B3 – С8 Н6 О4
. Очевидно, что и для A2-B2 следует принять
как минимум удвоенную формулу: С14 Н8 О2
. Таким образом, соединения A2, B2, A3, B3
формально сильно ненасыщенны и их относительная
устойчивость в реакциях окисления может быть
объяснена наличием в структуре ароматических
группировок. Из полученных данных следует, что
при окислении A2 в A3 происходит изменение
состава на две ОН-группы, т.е. происходит разрыв
связи С-С с образованием двух карбоксильных
групп, а при окислении B2 в B3 происходит
отщепление шести атомов углерода, т.е. отгорание
одного бензольного ядра. Тогда B3 может иметь
структуру фталевой кислоты, полученной
окислением антрахинона B2 , и углеводород B1
является антраценом.

Изомер антрацена, легко окисляющийся
без потери атомов углерода, - фенантрен A1 ;
первичный продукт его окисления A2 - ![]() -дикетон
фенантренхинон, который далее окисляется в
дифеновую кислоту A3.
-дикетон
фенантренхинон, который далее окисляется в
дифеновую кислоту A3.

Структура A2 подтверждается ее перегруппировкой под действием щелочи (бензильная перегруппировка) в соль 1-гидроксифлуорен-1-карбоновой кислоты A4 . Соль под действием разбавленной соляной кислоты превращается в свободную кислоту A5 , а при действии концентрированной соляной кислоты происходит замещение OH группы на Cl с образованием A6:

Антрахинон при сплавлении с бертолетовой солью в присутствии щелочи окисляется в ализарин B4:

Открытие этой реакции позволило осуществить промышленное производство красителей ализаринового ряда, которые ранее добывались из корней марены. Ликвидация посевов марены, занимавших до этого большие площади во Франции, привела к резкому изменению структуры сельскохозяйственных угодий во второй половине 19-го века.
III-10-10 . 1) Образование дивинила по Лебедеву протекает по молекулярному уравнению:
2С2Н5ОН = С4Н6 + 2Н2О + Н2
Из этого уравнения следует, что образование С4Н6 сопровождается процессами дегидрирования, дегидратации и сдваивания (конденсации) промежуточно образующихся веществ. При этом на каждый моль спирта выделяются 1 моль воды и 0,5 моля водорода.
2) Первым этапом превращения спирта могли бы быть либо дегидратация, либо дегидрирование. Однако дегидратация не может быть первым этапом, так как образующийся при этом этилен в условиях катализа по Лебедеву не образует бутадиен. Дегидрирование этанола протекает с образованием водорода и ацетальдегида:
СН3СН2ОН ![]() СН3СН=О + Н2 (1)
СН3СН=О + Н2 (1)
Сам ацетальдегид может образовывать продукты конденсации:
2СН3СН=О ![]() СН3СН(ОН)СН2СНО (2)
(альдоль)
СН3СН(ОН)СН2СНО (2)
(альдоль)
СН3 СН(ОН)СН2 СНО ![]() СН3 СН=СНСНО
(кротоновый альдегид)
СН3 СН=СНСНО
(кротоновый альдегид)
Этот процесс также не ведет к образованию бутадиена. Однако в присутствии водорода, имеющегося в реакционной среде (уравнение 1), альдоль может восстанавливаться до бутан-1,3-диола, дегидратация которого и дает бутадиен:
СН3СН(ОН)СН2СНО![]() СН3СН(ОН)СН2СН2ОН
(3)
СН3СН(ОН)СН2СН2ОН
(3)
СН3СН(ОН)СН2СН2ОН ![]() СН2
=СН-СН=СН2 (4)
СН2
=СН-СН=СН2 (4)
3) Реакции дегидрирования (1) и дегидратации (4) катализируются металлами VIII группы (Ni, Pt) или оксидными катализаторами (Cr2O3 ). Конденсация (2) может быть вызвана оксидами основного характера (MgO, ZnO). Типичными катализаторами процесса дегидратации (4) может быть оксид алюминия Al2O3 . (Здесь указаны только некоторые из возможных компонентов сложного катализатора).
4) Пропанол-1 по аналогичной схеме может образовать 2-метилпентадиен-1,3:
СН3СН2СН2ОН ![]() СН3СН2СНО
СН3СН2СНО![]() СН3СН2СН(ОН)СН(СН3)СНО
СН3СН2СН(ОН)СН(СН3)СНО
![]() СН3СН2СН(ОН)СН(СН3)СН2ОН
СН3СН2СН(ОН)СН(СН3)СН2ОН
![]() CH3СН=СНС(СН3)=СН2
CH3СН=СНС(СН3)=СН2
Из пропанола-2 при такой же последовательности реакций может образоваться 2,3-диметилбутадиен-1,3:
СН3СН(ОН)СН3![]() СН3СОСН3
СН3СОСН3
![]() (СН3)2С(ОН)СН2СОСН3
(СН3)2С(ОН)СН2СОСН3
![]()
(СН3)2С(ОН)СН2СH(ОН)СН3 ![]() СН2
=С(СН3)С(СН3)=СН2
СН2
=С(СН3)С(СН3)=СН2
III-10-11. 1. При сгорании газа Е образуется один продукт. Скорее всего Е – простое вещество. Газообразных простых веществ не так много: Н2, N2, O2, F2, Cl2 и инертные газы. Из них условию задачи удовлетворяет только Н2:
2Н2 + О2 ![]() 2Н2 О
2Н2 О
Тогда вещества А и В – скорее всего гидриды, выделяющие при реакции с водой водород.
Предположим, что А имеет формулу МНх тогда:
МНх + x Н2О ![]() М(ОН)х + хН2
М(ОН)х + хН2![]()
М(ОН)х + хNH4Cl ![]() MClx
MClx![]() + xNH3 + xH2O
+ xNH3 + xH2O

Даже если HgH2 и существует, при его взаимодействии с водой образуется HgO, который в воде не растворим.
Гидриды могут быть комплексными, например М1[M2H4 ] и при взаимодействии их с водой образуются растворы, содержащие гидроксокомплексы, например [M2(OH)4]- и другие. Тогда с NH4 Cl образуется осадок гидроксида, который при прокаливании переходит в оксид.
Предположим, что гидрид имеет формулу М1[M2H4 ], тогда
М1[M2H4] ![]() 1/2М22 О3
1/2М22 О3

Итак, А – Li[AlH4].
Вещество В имеет такую же молярную массу, что и А (равные навески выделяют равные объемы водорода).
МА = МВ = 38 г/моль
Подходит Na[BH4].
4Na[BH4] + 9H2O ![]() Na2B4O7 + 2NaOH +
16H2
Na2B4O7 + 2NaOH +
16H2 ![]()
Li[AlH4] + 4H2O ![]() Li[Al(OH)4] + 4H2
Li[Al(OH)4] + 4H2 ![]()
2H2 + O2![]() 2H2O
2H2O
Li[Al(OH)4] + NH4Cl ![]() Al(OH)3
Al(OH)3![]() + LiCl + NH3
+ LiCl + NH3
2Al(OH)3 ![]() Al2O3 + 3H2O
Al2O3 + 3H2O
2. Комплексные гидриды используют для
восстановления органических соединений:
1) RCHO + 2[H] ![]() RCH2OH;
RCH2OH;
2) RCOOR’ + 4[H] ![]() RCH2OH + R’OH;
RCH2OH + R’OH;
3) RCN + 4[H] ![]() RCH2NH2.
RCH2NH2.
3. Получение комплексных гидридов:
1) 4LiH + AlCl3 ![]() Li[AlH4] + 3LiCl.
Li[AlH4] + 3LiCl.
2) 4NaH + B(OCH3)3 ![]() NaBH4 + 3CH3ONa.
NaBH4 + 3CH3ONa.
III-10-12. В триангуланах плоскости соседних колец взаимно перпендикулярны.
Для [4] -триангулана существуют два пространственных изомера, являющиеся оптическими антиподами:

Для [5] -триангулана существуют три пространственных изомера, два из которых оптически активны и также являются оптическими антиподами, а третий оптически неактивен:
