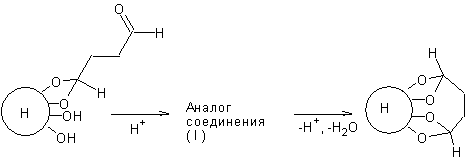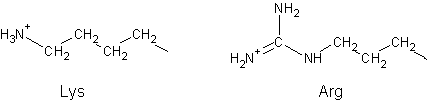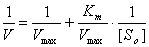Школьные олимпиады по химии
Всероссийская олимпиада школьников по химии - 2004 года
Всероссийская олимпиада школьников по
химии - 2004 года
РЕШЕНИЯ "ЗАДАЧ ПО ВЫБОРУ"
ФИЗИЧЕСКАЯ ХИМИЯ
Задача 1 (автор А. И. Жиров)
1. "…приведенные данные могут быть объяснены
распадением частиц галоидов на атомы; такое распадение
наступает наиболее трудно при хлоре, наиболее легко при
иоде, но и там при обыкновенном давлении не достигается
половинной плотности пара, которая бы отвечала полному распадению
двухатомных частиц галоидов на атомы. Под значительно уменьшенным
давлением, напр. при 0,3 атм. уже при 1500о плотность
пара иода = 4,6; а при большем разряжении и при несколько
нисшей температуре получается половинныя плотности пара
4,4, остающиеся затем постоянными при дальнейшем нагревании."
Т.е. термической диссоциацией молекул галогенов:
Г2 (газ)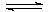 2Г(газ)
2Г(газ)
2. Из данных плотности ("ниже 440о ) можно
рассчитать молярные массы галогенов (в таблице приведены
относительные плотности по воздуху).
Хлор 2,45  29
= 71,05 D = ((35,453
29
= 71,05 D = ((35,453
 2) - 71,05)/71,05 = 0,002
D = 0,2%
2) - 71,05)/71,05 = 0,002
D = 0,2%
Бром 5,52  29
= 160,08 D = 0,17%
29
= 160,08 D = 0,17%
Иод 8,78  29
= 254,62 D = 0,3%
29
= 254,62 D = 0,3%
3. Состав "пара" для иода
Ниже 440о - I2.
440о : x - w I, (1-x)
-w I2;
126,9x + 253,8(1-x) = 8,72  29 = 252,88 x = 0,007 (0,7%)
29 = 252,88 x = 0,007 (0,7%)
900o: 8,11  29 =
235,19 = 253,8 - 126,9x x = 0,147 (14,7%)
29 =
235,19 = 253,8 - 126,9x x = 0,147 (14,7%)
1200o: 6,07  29
=176,03 = 253.8 -126,9x x = 0,613 (61,3%)
29
=176,03 = 253.8 -126,9x x = 0,613 (61,3%)
Выше 1400о: 5,31  29 = 153,99 x = 0,787 (78,7%)
29 = 153,99 x = 0,787 (78,7%)
4. Для равновесия: Г2 (газ)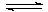 2Г(газ) константа равновесия будет
иметь вид:
2Г(газ) константа равновесия будет
иметь вид:
Kp = 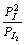 =
=
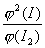 ,
,
считая, что измерения были выполнены при постоянном (атмосферном
давлении). Тогда из линейной зависимости lnKp
= -DH/RT + DS/R
можно рассчитать энергию связи I - I.
|
T, oC
|
w(I)
|
w(I2)
|
Kp
|
ln Kp
|
1/T, K
|
|
440
|
0,007
|
0,993
|
4,93×10-5
|
-9,92
|
0,00140
|
|
900
|
0,147
|
0,853
|
2,53×10-2
|
-3,677
|
0,0008525
|
|
1200
|
0,613
|
0,387
|
0,971
|
-0,294
|
0,000679
|
|
1400
|
0,787
|
0,213
|
1,979
|
0,683
|
0,000598
|
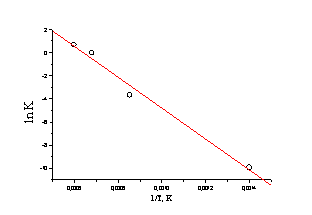
Тангенс угла наклона прямой составляет –13300, энергия
связи равна 13300  8,31 : 1000
= 111 кДж/моль ( современные справочные данные 149 кДж/моль).
8,31 : 1000
= 111 кДж/моль ( современные справочные данные 149 кДж/моль).
5. Зависимость давления пара от температуры описывается:
ln P = A + B/T, где B = -DH/R
(DH - энтальпия сублимации (над
твердым) или испарения (над жидкостью). Тогда для двух первых
значений А =24,158; B = -7649,8 . Уравнение давление пара
над твердым иодом:
ln P = 24,158 - 7649,8/T (1)
Два следующих значения не согласуются с этим уравнением,
т.е. эти значения соответствуют давлению пара над жидким
иодом. Коэффициенты для этого равновесия: A = 19,588; B
= 5924,3. Уравнение давления пара над жидкостью имеет вид:
ln P = 19,588 - 5924,3/T (2)
Общее решение этих двух уравнений даст температуру плавления
(температуру тройной точки). Т = 378 К или 105 оС
(справочное значение 113,6 оС). Температура кипения
- температура, при которой давление пара над жидкостью составляет
760 мм рт. ст. Подставляя в уравнение (2), получаем Т =
457 К или 184,3 оС (справочное значение 185,5
оС).
Энергия молекулярной решетки равна энтальпии сублимации.
Исходя из уравнения (1), имеем 7649,8  8,31 : 1000 = 63,6 (кДж/моль). Справочное значение - 57,6
кДж/моль.
8,31 : 1000 = 63,6 (кДж/моль). Справочное значение - 57,6
кДж/моль.
Задача 2 (автор С.А.Серяков)
1. Поскольку кислота HX – органическая, значит,
она содержит в своем составе углерод. Тогда каждое из неизвестных
веществ также содержит углерод, теперь можно с уверенностью
утверждать, что A– метан(CH4), поскольку
массовая доля водорода в веществах из числа вообразимых
продуктов взаимодействия H2S + CS2
не менее 25%.
Превращение AвB– сульфоокисление метана, приводит
к CH3SO3H(B), этот состав также
может быть рассчитан из соотнощения S : Н и учета одноосновности
B(по аналогии с HX). Фторирование В
в электролизере приводит к замене всех атомов Н при CH3
– группе на фтор, что также подтверждается расчетом. HX
– CF3SO3H.
Относительное уменьшение массовых долей S и H при переходе
от D к HX – одинаково, можно предположить,
что происходит окисление CF3SH: это подтверждается
определением количества введенных атомов O: n(O) = Ar(S)*(1/ωD(S)
-1/ωHX(S))/Ar(O) = 3.
D - CF3SH. Судя по тому что в соединении
С - доля серы невелика, то (вероятно) оно содержит
ртуть, тогда действием сероводорода ее катионы осаждаются
и заменяются на водород. C – Hg(SCF3)2.
Уравнения реакций:
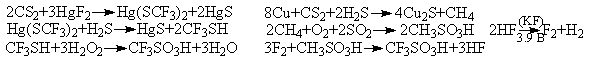
2. а) Ka(HF)=[H+][F-]/[HF]
=> [F-]=Ka(HF)[HF]/[H+];
E0=E0(F2/F-)-RT/F·ln{Ka(HF)}
Уравнение Нернста примет вид: Е=E0+RT/2F·ln{[F2][H+]2/[HF]2}
б) Уравнения материального баланса и баланса по зарядам:
C1 = [FX]+[F2] = [F2]+[HF]+[F-];
C2 = [FX]+[HX]+[X-] = [H+]+[HX]+[HF];
[H+] = [F-]+[X-]
Приближения: Ka(HF)<<K1-3 =>
[F-] ≈ 0; K2>>1 =>
[H+] = [X-], [HX] ≈ 0. После
вычитания первой системы равенств из второй: С2
– С1 = [X-]+[HX]- [X-]-[F2]
=> [F2] = C1 – C2 +[H+]
и далее получим [HF] = C2 –[H+]. ΔE1
=E - E0 = RT/2F·ln{(C1–C2
+10-pH)·10-2pH/(C2–10-pH)2}.
На первый взгляд кажется что [F2] в зависимости
от рН может быть отрицательна, однако рН связан, в свою
очередь, сложным образом с С1 и С2.
3. Вероятные основные процессы с участием:
а) BF3:(i)BF3+SolvH = BF3Solv-+H+;
(ii)BF3+HF = BF4-+H+
процесс(ii) предпочтительнее, т. к. образуется более слабое
основание-анион. => [H+]-[H+]0
= C3;[HF]-[HF]0= -C3.
 E(а) = RT/2F·ln{(C1
-10-pH)·(10-pH+C3)2/(C2-C3-10-pH)2}.
Заметно, что кислота Льюиса повысила потенциал, что
иллюстрирует взаимосвязь понятий кислоты и окислителя.
E(а) = RT/2F·ln{(C1
-10-pH)·(10-pH+C3)2/(C2-C3-10-pH)2}.
Заметно, что кислота Льюиса повысила потенциал, что
иллюстрирует взаимосвязь понятий кислоты и окислителя.
б) NaX: равновесие (3): K2[F2][X-]
= [F-][FX] = KHF[FX][HF]/[H+]
=> вследствие малости С3 – оно не может сильно
повлиять на [X-] и [H+](=>и на
[FX],[HF] )(Из уравнения ([F2]/[FX][HF])0=([F2]/[FX][HF])’,
полученном при [X-][H+]≈const
расход С3 равен нулю.), значит [F2][X-]
≈ const.
 E(б)=ΔE1+RT/2·Fln([F2]/[F2]0)=ΔE1+RT/2F·ln([X-]0/[X-])=ΔE1+RT/2F·ln{10-pH/(C3+10-pH)}
– даже слабое основание понижает потенциал системы
(делает ее «восстановительней»).
E(б)=ΔE1+RT/2·Fln([F2]/[F2]0)=ΔE1+RT/2F·ln([X-]0/[X-])=ΔE1+RT/2F·ln{10-pH/(C3+10-pH)}
– даже слабое основание понижает потенциал системы
(делает ее «восстановительней»).
4. В первой реакции принимают участие нейтральные молекулы,
поэтому полярность среды и ее способность отдавать протон
влияют незначительно. Второй процесс протекает количественно,
поскольку кислота очень сильная, образующийся ион X-
обладает малым сродством к протону и слабо поляризуем. Ион
F- сильно сольватируется в протонных растворителях(вплоть
до образования HF), т. к. обладает большим сродством к протону
(Ka(HF)<<K1-3), поэтому увеличение
Ka(solv) способствует росту K3. Kaрастетвряду:
CH3OH<CF3CH2OH<CH3CO2H<HCO2H<CF3CO2H.
[F2]- уменьшается, [HF] – растет, уменьшая [H+],
значит Е – уменьшается.
5. Выбор экспериментаторов привлекает HCO2H,
поскольку продукты взаимодействия со фтором – газообразные,
после насыщения раствора фтором потенциал поддерживается
все время примерно равным потенциалу окисления растворителя,
а карбоновые кислоты образуют со фтором нечто похожее на
FX.( Подробнее с химией молекулярного фтора в растворителях
можно познакомиться в цикле статей «Elemental Fluorine»
в журнале «Journal of Fluorine Chemistry».)
6. Предположим, что лаборатория не столь «продвинутая»
и не располагает возможностью использовать способ «из баллона»
или разложение XeF2, CeF4, CoF3
и прочих высших фторидов для получения F2. Кроме
того, в производстве этих соединений применяют фтор, генерированный
в электролизере.
Возможный способ получения из доступных реагентов:
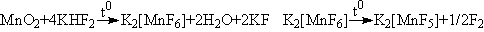
Первая реакция: расплав KHF2(60-800),
вторая: нагревание сухой соли при t0>1800.
7. Невозможно в рассматриваемой системе осуществить электродный
процесс, обратимый ( ) по фтору (F2+2e-+2H+
) по фтору (F2+2e-+2H+ 2HF), что необходимо для точного определения
потенциала. Причины этого – главным образом побочные реакции
на электроде.
2HF), что необходимо для точного определения
потенциала. Причины этого – главным образом побочные реакции
на электроде.
Задача 3 (авторы А.С.Белов, В.В.Еремин).
1) Озонолиз бензола происходит последовательно
по трем связям углерод-углерод:
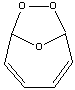
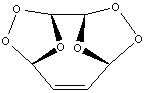
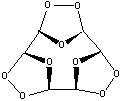
А1
А2
А3
Конечный продукт A3 представляет собой рыхлую
белую массу, довольно взрывоопасную. При его восстановлении
цинком образуется глиоксаль:
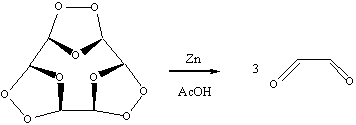
2)
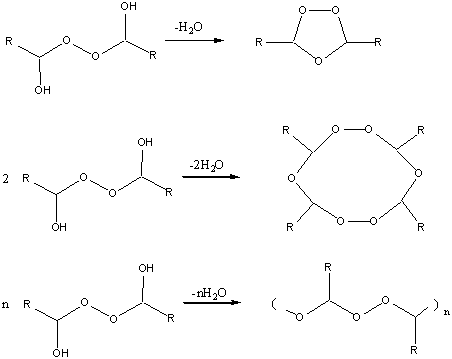
3) Аналитический сигнал – появление оранжевого окрашивания
вследствие образования катиона пероксотитанила:
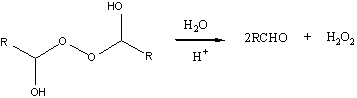
H2O2 + [TiO(H2O)n]2+
= H2O + [TiO2(H2O)n]2+
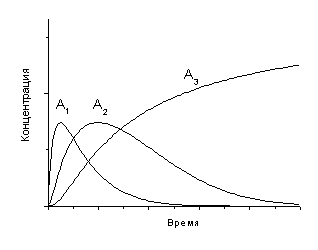
4) а) Вещество А3 будет непрерывно накапливаться
в системе, а концентрации веществ А1 и А2
сначала будут возрастать, а затем, достигнув максимума,
спадут до нуля, так как все три реакции необратимы, а озон
находится в избытке
Из кинетической схемы следует, что скорость
образования продукта имеет вид:
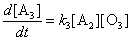
Эта величина равна нулю как в начальный момент времени,
так и в конце реакции, следовательно в какой-то промежуточный
момент времени она имеет максимум. Наличие максимума производной
d[A3]/dt означает, что кривая [A3](t)
имеет перегиб.
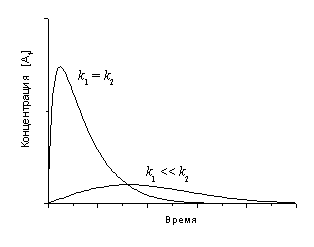
б) В первом случае, когда k1
<< k2, вещество A1 медленно
образуется и быстро расходуется, поэтому его максимальная
концентрация невелика. Во втором случае, при k1»
k2, скорости образования и расходования
A1 сопоставимы, поэтому максимальная концентрация
достигается раньше и имеет большее значение, чем в первом
случае.
в) Первая стадия озонолиза приводит к разрушению
устойчивой ароматической системы, поэтому можно ожидать,
что это – процесс медленный и константа скорости k1
будет намного меньше констант скорости последующих стадий.
Приближение (б1) больше соответствует действительности.
г) Запишем условия стационарности концентраций
веществ А1 и А2:
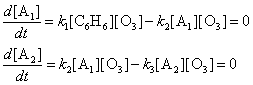
Эти уравнения позволяют получить простое выражение для
скорости образования продукта:
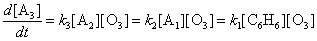
Общий порядок реакции равен двум.
5) а) В условиях постоянства концентрации озона
уравнение из п. (4г) сводится к следующему:
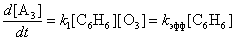 ,
,
где kэфф = k1[O3]0.
Реакция приобретает общий первый порядок.
б) Для реакций первого порядка время полупревращения
реагента не зависит от начальной концентрации, так что при
увеличении концентрации бензола в 2 раза оно не изменится.
в) Для того, чтобы найти зависимость концентрации
продукта A3 от времени, необходимо сначала рассчитать
концентрацию бензола как функцию времени. Превращение C6H6
в A1 – реакция первого порядка в условиях постоянства
концентрации озона:
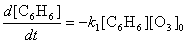 .
.
Это уравнение имеет обычное экспоненциальное решение:
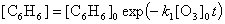
Теперь можно заметить, что в приближении стационарности
A1 и A2 скорость расходования бензола
в точности равна скорости образования продукта A3:
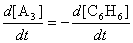
Это означает, что в любой момент времени сумма концентраций
A3 и C6H6 постоянна (и
равна начальной концентрации бензола). Отсюда находим концентрацию
A3:
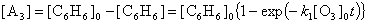
Задача 4 (автор И.А.Леенсон).
1. Для АИБН: NC–С(СH3)2–N=N–C(CH3)2–CN
→ 2.C(CH3)2CN + N2;
2.C(CH3)2–CN → NC–С(СH3)2–C(CH3)2–CN
(динитрил тетраметилбутандиовой (янтарной) кислоты. Для
ПБ: С6Н5–СО–О–О–СО–С6Н5
→ 2С6Н5СО–О.; далее
образовавшиеся бензоилокси-радикалы могут отщеплять СО2:
С6Н5СО–О. → .С6Н5
+ СО2 (реакции способствует высокая стабильность
СО2 и делокализация неспаренного электрона в
бензольном кольце) с последующей рекомбинацией радикалов
с образованием бифенила: 2.С6Н5
→ С6Н5–С6Н5
и фенилового эфира бензойной кислоты (фенилбензоата): .С6Н5
+ С6Н5СО–О. → С6Н5СО–О–С6Н5.
2. Легкому распаду молекул азосоединений способствует образование
очень прочной связи в молекуле азота, что значительно снижает
энергию активации распада по сравнению с энергией разрыва
химических связей.
3. Распад ИИБН – реакция 1-го порядка, для которой концентрацию
(c) можно выражать в любых единицах (например, через
объем выделившегося азота), что видно из интегрального уравнения
ln(co/c) = kt; соответственно,
в размерность константы концентрация не входит. Тогда со
= 1250 ед., с(t = 1 мин) = 1249,5 ед. Видно,
что за 1 мин реакция прошла на ничтожную глубину, т.е. начальный
участок кинетической кривой – прямая линия. Это значит,
что скорость реакции в течение 1-й минуты постоянна и равна
0,5 ед./мин. Из уравнения для начальной скорости vо
= kcо получаем k = vo/co
= 0,5/1250 = 4.10–4 мин–1
= 6,6.10–6 с–1.
4. Сначала рассчитаем константу скорости при 25оС:
k = 1015e–130000/8,31.298 =
1,66.10–8 с–1. Время полураспада
t = ln2/k = 4,17.107
с ~ 1,3 года. При распаде на 0,1% (или на 0,001) скорость
реакции можно считать постоянной (см. ответ на п.3): Δc/Δt
= kco, откуда Δt = Δco/kco
= 0,001/k = 6,02.104 с ~ 16,7
часа. Чтобы вещество распалось за 5 ч на 50%, константа
скорости должна быть равна ln2/t1/2 =
0,693/18000 c = 3,85.10–5 с–1.
Из уравнения k = 1015e–130000/8,31T
получаем Т = 349,6 К или, с учетом точности исходных
данных, ~ 76,5оС.
5. При распаде молекулы АИБН рвутся две связи С–N (затрачивается
2.295 = 590 кДж) и выделяется за счет образования
связи С–С 340 кДж. Чтобы рассчитать тепловой эффект образования
азота, представим, что разорвалась связь N=N (затрачено
420 моль) и образовалась молекула N2 (выделилось
945 кДж). Общий итог: затрачено 590 + 420 = 1010 кДж, выделилось
340 + 945 = 1285 кДж, т.е. реакция сильно экзотермическая,
с тепловыделением 275 кДж/моль. Эта реакция может идти со
взрывом, если выделяющаяся теплота не будет успевать отводиться
в окружающее пространство, т.е. если реакция будет идти
слишком быстро. Подобное произойдет, если проводить разложение
большого количества АИБН при слишком высокой температуре.
6. Запишем выражение для начальной скорости реакции, идущей
одновременно по двум механизмам: vo =
kIco + kIIco2
= co(kI + kIIco).
Если считать, что реакция 1-го порядка, т.е. vo
= kэффco, то из эксперимента
будет определена эффективная константа 1-го порядка kэфф
= kI + kIIco;
не удивительно, что она зависит от со
и растет с ростом концентрации. График зависимости kэфф
от co представляет собой (как и следовало
ожидать) прямую, из наклона которой находим kII
= 1,09.10–4 л/(моль с), а из отсечения
на оси ординат – значение kI = 4,2.10–5
с–1.
7. Стабильность радикала указывает на образование семихиноновой
ароматической структуры. Такая структура возникает, например,
при окислении гидрохинона с образованием О–С6Н4–О.,
в котором происходит очень сильная делокализация неспаренного
электрона (в "чистом" семихиноне он принадлежит
поровну двум атомам кислорода, а значительная его плотность
приходится также на бензольное кольцо). В данном случае
подобная структура может возникнуть только в результате
присоединения активного свободного радикала, образовавшегося
при распаде АИБН, по двойной связи С=О в хиноне. Остается
определить, по какой из двух связей и по какому ее концу
произошло присоединение. Спектр ЭПР указывает на высокую
электронную плотность на шести эквивалентных протонах (это
могут быть только метильные группы) и на меньшую плотность
на двух эквивалентных протонах (протоны кольца). Следовательно,
группа, несущая неспаренный электрон (–О.) находится
в орто-положении к метильным группам и в мета-положении
к оставшимся атомам Н. Объемистый заместитель (СН3)2С–СN
не может присоединиться к атому С карбонильной группы, но
может присоединиться к атому кислорода. Итак, окончательная
структура радикала:
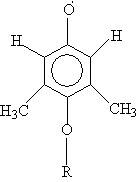
где R – остаток инициатора.
И последний вопрос. АИБН – стандартный инициатор при лабораторном
исследовании радикально-цепных реакций полимеризации. Отсюда
и выбор "полимерного" журнала.
ХИМИЯ И ЖИЗНЬ
Задача 1 (автор Д.М.Жилин)
1. По первой гипотезе:М2+ + CO32-
= MCO3
3М2+ + 2PO43- = M3(PO4)2
По второй гипотезе: М2+ + HCO3-
+ OH- = MCO3 + H2O.
+ H2O.
2. По всему озеру, так как в единственной вытекающей из
озера реке концентрация солей также понижена.
3. А) Если бы повышение рН было обусловлено внесением карбоната
или фосфата натрия, то вся свободная щелочность была бы
обусловлена карбонат- или фосфат-ионами. При этом в растворе
присутствовали бы ионы натрия в количестве, эквивалентном
удвоенному количеству карбоната или утроенному количеству
фосфата. В этом случае жесткость (суммарная концентрация
ионов Ca2+ и Mg2+) составляла бы половину
от разницы между свободной и общей щелочностью, то есть
(2.00 - 0.5)/2 = 0.75 мМ. Она же составляет
0.95 мМ, что практически равно половине общей щелочности
(1.0 мМ).
Б) Для того, чтобы в объеме воды 1м 20м
20м 20м
= 400м3 = 4000000л (уж в таком-то объеме вода
заведомо перемешивается) создать свободную щелочность (то
есть концентрацию карбонат- или фосфат-ионов) 0.5 моль/л,
в этот объем необходимо высыпать
20м
= 400м3 = 4000000л (уж в таком-то объеме вода
заведомо перемешивается) создать свободную щелочность (то
есть концентрацию карбонат- или фосфат-ионов) 0.5 моль/л,
в этот объем необходимо высыпать
106г/моль 0.005моль/л
0.005моль/л ;400000л
= 21000 г = 21 кг
;400000л
= 21000 г = 21 кг
карбоната натрия (или близкую к тому массу фосфата натрия),
что составляет не менее 50 кг стирального порошка. Это соответствует
как минимум пятистам очень неэкономных постирушек в столь
незначительном объеме. Маловероятно, чтобы каждый сороковой
житель Галича прибыл в одно время и в одно место для столь
увлекательного занятия.
В) Посчитаем рН раствора, содержащего 0.5 мМ карбонат-ионов
и 2.0 - 2 0.5 = 1.0
мМ гидрокарбонат-ионов. Из определения константы кислотности
следует, что
0.5 = 1.0
мМ гидрокарбонат-ионов. Из определения константы кислотности
следует, что
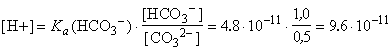 .
.
Значит, рН = -lg[H+] = 10.
Это заметно меньше, чем наблюдаемый рН 10.8. В случае,
если щелочность обусловлена фосфатами, расчет становится
невозможен, так как сосуществование фосфатов и гидрокарбонатов
невозможно:
PO43- + HCO3-
= HPO42- + CO32-
(см. ответ 4А).
Г) Если предположить, что свободная щелочность обусловлена
карбонатами, получаем
[Ca2+] [CO32-]
= 0.45
[CO32-]
= 0.45 10-3
10-3 ;0.5
;0.5 10-3 = 2.2
10-3 = 2.2 10-7,
10-7,
что на два порядка превышает ПР(CaCO3). Аналогично,
если предположить, что свободная щелочность обусловлена
фосфатами, то [Ca2+]3 [РO43-]2
= (0.45
[РO43-]2
= (0.45 10-3)3
10-3)3 (0.5
(0.5 10-3)2 = 2.3
10-3)2 = 2.3 10-17,
10-17,
что превышает ПР(Ca3(PO4)2)
на 12 порядков. С другой стороны, осадки могут выпадать
медленно...
4. Наблюдается сосуществование гидроксид-ионов и слабых
оснований (дающих 2.0 - 2 0.5 = 1.0
мМ свободной щелочности). Это странно для любой гипотезы
и может быть объяснено только тем, что взаимодействие между
ними происходит медленно.
0.5 = 1.0
мМ свободной щелочности). Это странно для любой гипотезы
и может быть объяснено только тем, что взаимодействие между
ними происходит медленно.
5. Аналогично ответу 3Б. Чтобы снизить жесткость с 3 до
1 мМ (и, соответсвенно, щелочность с 6 до 2 мМ), нужно на
1 моль щелочности (0.5 моль жесткости) выбросить 0,5 моль
Ca(OH)2. Объем озера примерно
25000м  5000м
5000м
 1.5м
1.5м  1000м/л = 2
1000м/л = 2 1011л.
1011л.
Это означает, что в озеро за год (время водообмена) нужно
выбросить
4 108моль = 3
108моль = 3 1010
г = 30000 т. Это примерно 500 вагонов. Сплошное разорение.
1010
г = 30000 т. Это примерно 500 вагонов. Сплошное разорение.
6. Поскольку озеро мелкое, оно должно хорошо прогреваться
и в нем может идти реакция
М2+ + 2HCO3-
= MCO3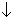 + H2O
+ CO2.
+ H2O
+ CO2.
Аналогичный процесс может идти под действием живых организмов,
строящих себе внешний скелет.
7. Если в иле обнаружатся значительные количества карбонатов
кальция и магния, то гипотеза верна. Иначе – нет.
8. Средняя высота столба воды в озере – 1.5м. Если взять
столб с площадью основания 1 дм2, то его объем
будет равен 15 л. За год происходит полный обмен воды в
это объеме. При этом концентрация кальция уменьшается примерно
с 2 мМ до 0.4 мМ, а магния – с 3‑1=1 мМ до 1‑0.4=0.6
мМ То есть из 1 л выпадает 1.6 ммоль CaCO3 и
0.4 ммоль MgCO3. Это соответствует 160 мг CaCO3
и 33 мг MgCO3, итого ~0.2 г (можно было бы просто
посчитать, что снижение жесткости обусловлено выпадением
CaCO3, ибо их с MgCO3 молярные массы
близки). Значит, из всего столба выпадет 0.2×15 = 3
г осадка. Эта масса занимает объем 3г/2000г/дм3 = 0.0015
дм3, что при площади основания в 1 дм2
дает слой 0.0015дм = 0.15 мм.
Автор благодарит А.А. Жданова за финансовую и лабораторию
L-Micro за аппаратную поддержку
работы, результаты которой легли в основу этой задачи.
Задача 2 (автор И.А.Трушков)
Соединение В содержит 62.1% углерода, 27.6% кислорода и
10.3% остальных элементов (в том числе обязательно водорода).
Отсюда можно вывести, что соотношение С:О в соединении В
равно 3:1, а массовая доля прочих элементов в 6 раз меньше
массовой доли углерода. Это позволяет предположить, что
соединение В имеет формулу (С3Н6О)х.
Но необходимо проверить и другие варианты (С3ОZn)x.
|
X
|
масса С
|
масса О
|
масса Z
|
|
1
|
36
|
16
|
6
|
|
2
|
72
|
32
|
12
|
|
3
|
108
|
48
|
18
|
|
4
|
144
|
64
|
24
|
|
5
|
180
|
80
|
30
|
Соединение Г содержит 71.75% брома. Атомы брома вводятся
в результате замещения пентафторидом фосфора атомов кислорода
спиртовых и карбонильных групп. Возможны следующие реакции:
ROH + PBr5®RBr
RR’C=O + PBr5®RR’CBr2
RCH2COOH + PBr5 (PBr3
+ Br2) ® RCHBrCOBr
Напротив, простые (ROR’) и сложные (RCOOR’) эфиры в реакцию
не вступают.
Таким образом, один атом кислорода может замещаться на один
или два атома брома.
|
Число атомов брома
|
Масса R в RBrx
|
Число атомов С в молекуле В
|
|
1
|
31.5
|
3 (масса С = 36, > 31.5)
|
|
2
|
63
|
3 или 6 (масса С = 72).
|
|
3
|
94.5
|
6 или 9 (масса С = 108)
|
|
4
|
126
|
6, 9 или 12 (масса С = 144)
|
|
5
|
157.5
|
9, 12 или 15 (масса С = 180)
|
Таким образом, замещение только спиртовых групп не удовлетворяет
условиям задачи: масса атомов углерода в R больше, чем масса
самого остатка R. Сравнивая таблицы 1 и 2, получаем, что
масса R = 126 (четыре атома брома в соединении Г) может
быть получена только в случае х = 3 (108 + 18), что соответствует
единственно возможной формуле С9H18O3.
Следовательно, соединение В содержит две спиртовых группы
и одну карбонильную. Оно может образоваться в результате
гидролиза внутримолекулярных бициклических кеталей, которыми
являются соединения А и Б. В принципе существует четыре
возможных изомера кеталей А и Б такого состава:
При гидролизе они образуют, соответственно, кетодиолы О-С:
Последние два соединения можно отбросить, поскольку при
нагревании в присутствии пара-толуолсульфокислоты
вместо образования исходных кеталей, содержащих четырех-
и восьмичленный циклы (и тем более трех- и девятичленный
циклы) в этих случаях будут протекать межмолекулярные реакции.
Для определения истинной структуры соединений А и Б рассмотрим
приведенную цепочку реакций.
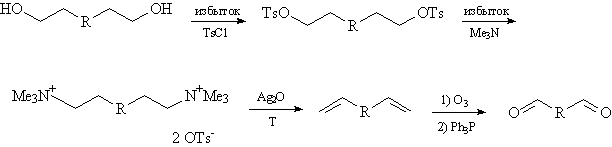
Для исходных соединений со структурой О и П конечные продукты
в этой цепочке будут иметь следующие формулы:
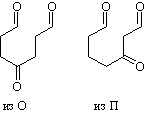
Смесь двух спиртов при действии одного эквивалента реактива
Гриньяра образуется только из первого продукта. Таким образом,
соединение В имеет формулу HO(CH2)4C(O)(CH2)4OH,
а соединения А и Б представляют собой два энантиомера:
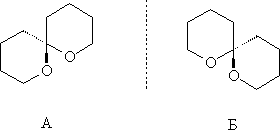
Задача 3 (авторы: А.В. Бачева, А.К. Гладилин)
1. Активация носителя
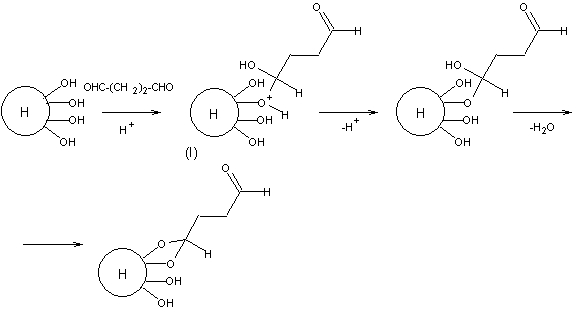
2. Побочная реакция. Кроме взаимодействия диальдегида с
носителем по одной СНО группе, возможно взаимодействие по
двум СНО группам, приводящее к поперечной сшивке матрицы.
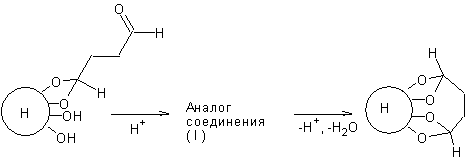
3. Взаимодействие активированного носителя с ферментом
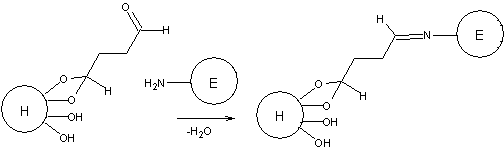
4. Реакция взаимодействия активированного носителя с белком
будет проходить по боковым аминогруппам лизина и аргинина:
5. Реакция взаимодействия активированного носителя с белком
может проходить и по концевой аминогруппе.
6. При взаимодействии белка с носителем образуется основание
Шиффа, неустойчивое в кислой среде, устойчивое в нейтральных
и щелочных средах.
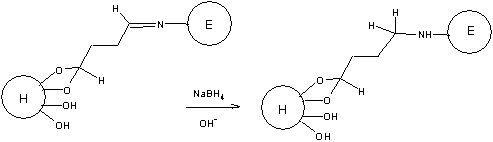
7. Для увеличения стабильности связи белок-носитель обычно
используют восстановление двойной связи C=N, например, боргидридом
натрия.
8.
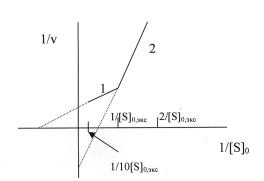
9. Преобразование уравнения (2) к двойным обратным координатам
приводит к уравнению:
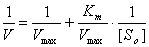
Отсюда видно, что прямая, описываемая данным уравнением,
отсекает на оси абсцисс отрезок, равный -1/KM,
а на оси ординат – отрезок, равный 1/Vmax.
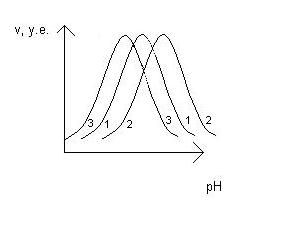
10. Полианионный носитель характеризуется наличием на поверхности
большого количества отрицательно заряженных групп. Эти группы
будут концентрировать протоны, в результате чего рН у поверхности
носителя, а, следовательно, и в микроокружении фермента
будет ниже, чем в объеме растворителя. Для компенсации данного
эффекта концентрирования протонов необходимо использовать
исходный растворитель с большим значением рН. Другими словами,
концентрирование протонов у поверхности полианионного носителя
приводит к сдвигу рН-профиля вправо. Аналогичные рассуждения
справедливы и для поликатионного носителя.


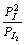 =
=
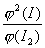 ,
,
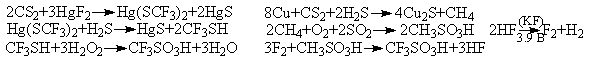
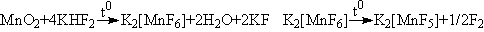





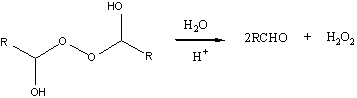
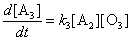


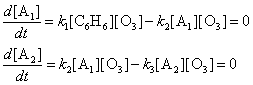
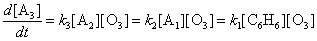
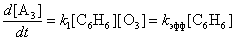 ,
,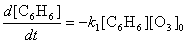 .
.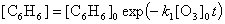
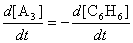
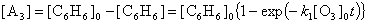

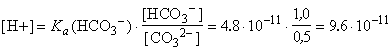 .
.