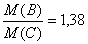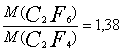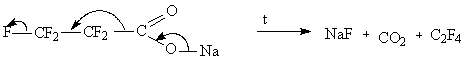|
Школьные олимпиады по химии
Всероссийская олимпиада школьников по химии - 2004 года
Всероссийская олимпиада школьников по химии - 2004 г.
ДЕСЯТЫЙ КЛАСС
(Решения)
Задача 10-1 (автор О. К. Лебедева)
1.Реакция иода с тиосульфатом
I2 + 2Na2SO3 = 2NaI + Na2S4O6
 экв(1) = экв(1) =  экв(S2O3
2-) = 10-2 экв(S2O3
2-) = 10-2 4 4  10-2 = 4 10-2 = 4 10-4 (моль) 10-4 (моль)
Соединение 1 -калиевая соль, изоморфная
манганату или сульфату - содержит
тетраэдрический анион и может быть представлена
в виде K8-nAO4, где n – степень окисления
А.
K8-nAO4 –окислитель, принимающий в
реакции с иодидом Z электронов, тогда
Мэкв(1) =m/  экв(1) = 0,0198/0,0004 =
49,5г/моль экв(1) = 0,0198/0,0004 =
49,5г/моль
M(1) = Мэкв(1) Z = 49,5 Z = 49,5 Z Z
М(1) = (8-n)39 + M(A) +4 16 = 376 -39n + M(A) 16 = 376 -39n + M(A)
Найдем А перебором
|
Z |
3 |
4 |
5 |
6 |
| n |
|
|
|
|
| 6 |
6,5 |
56 |
105,5 |
155 |
| 7 |
45,5 |
95 |
144,5 |
195 |
При Z=4 и n=6 M(A)=56, A - Fe
При Z=6 и n=7 M(A)=195, тогда А –Pt, однако, полученные степени окисления
(+7 и +1) не характерны для платины и кроме того платину используют как нерастворимый
анод.
Итак, соединение (I) – феррат калия K2FeO4.
K2FeO4 + 4 KI + 4H2SO4
= FeSO4 +2I2 +4H2O + 3K2SO4
Найдем металл Б
Б + nHCl = БCln + 0,5nH2
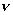 экв(H2) = экв(H2) = 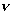 экв(Б)
= 0,07/11,2 =0,00625 экв(Б)
= 0,07/11,2 =0,00625
Мэкв(Б) =m/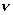 экв(Б) = 0,1/0,00625 = 16г/моль экв(Б) = 0,1/0,00625 = 16г/моль
Найдем Б перебором.
При n=3 получаем титан, который находится в одном периоде с железом
Для платины металла отвечающего условию задачи нет.
Б – Ti.
2. Интерметаллид имеет состав FeTi.
M(FeTi)= 104
 (FeTi) = 1/104 = 0,0096моль (FeTi) = 1/104 = 0,0096моль
 (H2) = 0,0215/22,4=0,0096моль (H2) = 0,0215/22,4=0,0096моль
Отсюда следует, что соединение 2 имеет состав FeTiH2.
3. Поскольку соединение 2 легко отдает водород,
то его можно использовать в водородной
энергетике
Задача 10-2 (автор О.К. Лебедева).
1. Винным спиртом называют этиловый спирт.
2. Из опытов ясно, что нафталидам имеет формулу CxHyNz
.Его солянокислая соль имеет состав CxHy +1NzCl
Исходя из данных таблицы, содержание азота в соли
составляет 100 -66,59 -5,61 -19,03=8,77%, отсюда
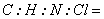  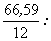 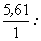 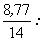 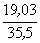  = 5,55 : 5,61 : 0,66 :
0,54 ~ 10:10:1:1 = 5,55 : 5,61 : 0,66 :
0,54 ~ 10:10:1:1
Аналогичный расчет для образца нафталидама
дает результат по усредненным данным 1 и 2 опытов
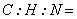 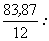 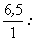 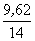 = 6,99 : 6,5 :0,69 = 10:9,4:1 = 6,99 : 6,5 :0,69 = 10:9,4:1
На основании результатов всех опытов, с
учетом погрешностей эксперимента, формула нафталидама
C10H9N
3. 2C10H9N +24,5 O2 =20 CO2 + 9H2O
+ N2 (оп.1,2)
2C10H10NCl +24,5 O2 + CuO = CuCl2
+ N2 +10H2O +20CO2
2C10H10NCl +30 O2 + 20 CaO 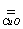 CаCl2 + N2 +10H2O
+20CaCO3 CаCl2 + N2 +10H2O
+20CaCO3
В оп.1 и 2 оксид меди и хромат свинца нужны для полного окисления нафталидама
в оксид углерода.
4. Согласно описанным свойствам и
брутто-формуле можно преложить, что графическая
формула нафталидама
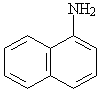 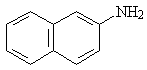
a-нафтиламин и b-нафтиламин
(1-нафтиламин и 2-нафтиламин)
5.
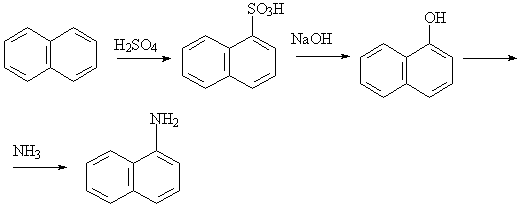
Если этот синтез проводить при нагревании (при
температуре выше 160оC), то получается
2-нафтиламин, а при более низких температурах
получается 1-нафтиламин
Задача 11-3 (автор Ю.Н.Медеведев).
1. Молярная масса соли Na3Y составит 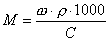 = 207,7
г/моль. С учетом трехосновности кислоты и наличия
в ней кислорода наиболее вероятная формула соли
Na3ЭО4. Тогда М(Na3ЭО4) = 69 +
А(Э) + 64 = 207,7, откуда А(Э) = 74,7 г/моль, что отвечает
мышьяку. Итак, H3AsO4 – мышьяковая
кислота. = 207,7
г/моль. С учетом трехосновности кислоты и наличия
в ней кислорода наиболее вероятная формула соли
Na3ЭО4. Тогда М(Na3ЭО4) = 69 +
А(Э) + 64 = 207,7, откуда А(Э) = 74,7 г/моль, что отвечает
мышьяку. Итак, H3AsO4 – мышьяковая
кислота.
2. а). AsO43– + H2O 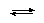 HAsO42– + OH– HAsO42– + OH–
[OH–] = 10–14/[H+] = 10–14/10–12,26
= 1,82•10–2
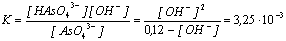
Ka3 = 10–14/3,25•10–3 = 3,07•10–12
( pKa3 = 11,51)
б).Для кислых солей в довольно широком интервале концентраций величина
рН раствора не зависит от концентрации соли, и определяется по формуле рН =
1/2(рКn + рКn+1). Так как для Na2HAsО4
рН = 9,15, то 9,15 = 1/2 • (рКа2 + рКа3).
С учетом найденного выше значения рКа3, находим рКа2
= 6,79 (или Ка2 = 1,62•10–7).
в). Аналогично, для NaH2AsО4 рН = 4,51, отсюда
4,51 = 1/2 • (рКа1 + рКа2). С учетом найденного
ранее значения рКа2, величина рКа1 = 2,23
(или Ка1 = 5,89•10–3).
3.
|
Соль
|
Равновесия
|
Константа
|
|
Na3AsО4
|
AsO 43– + H 2O 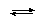 HAsO 42– + OH – |
Kb = 3,25•10–3
|
|
Na2HAsО4
|
НAsO 42– + H 2O 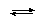 H 2AsO 4– + OH – |
Kb = 6,17•10–8
|
| -
|
НAsO 42– + H 2O 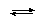 AsO 43– + H 3O + |
Ka = 3,07•10–12
|
|
NaH2AsО4
|
H 2AsO 4– + H 2O
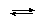 H 3AsO 4 + OH – |
Kb = 1,70•10–12
|
|
-
|
H 2AsO 4– + H 2O
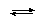 НAsO 42– + H 3O + |
Ka = 1,62•10–7
|
4. Из выражения для Ка2 мышьяковой
кислоты найдем соотношение концентраций
соответствующих солей:
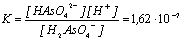 , , 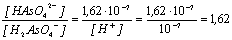
5. Арсин. Его образование и возможная
очистка:
4Zn + H2AsO4– + 9H+  4Zn2+ + 4H2O + AsH3
4Zn2+ + 4H2O + AsH3
5AsH3 + 8MnO4– + 19H+  5H2AsO4– + 8Mn2+ + 12H2O
5H2AsO4– + 8Mn2+ + 12H2O
6.Например:
As + 5HNO3 (конц)  H3AsO4 + 5NO2 + H2O
H3AsO4 + 5NO2 + H2O
Задача 10-4 (автор В.А.Емельянов).
1. Из описанных способов получения очевидно, что А является калиевой
солью угольной кислоты. Учитывая, что в способах в) и г) процедуре получения
А предшествует нагревание при высокой температуре, соль не содержит гидрокарбонат-иона.
Рассчитаем ее состав ( поскольку данные термического
анализа приведены с 4 значащими цифрами, в данном решении расчет проведен также
с учетом 4 значащих цифр необходимых атомных масс). Нагревание до 200 оС
может привести только к удалению кристаллизационной воды. В остатке - карбонат
калия, который при молекулярной массе 138,21 а.е.м. составляет 100-16,36 = 83,64
% от массы А. Потеря массы 16,36% отвечает 0,1636 138,21/0,8364
= 27,03 а.е.м. на молекулу А, что соответствует 1,5 молекулам H2O.
А - K2CO3 138,21/0,8364
= 27,03 а.е.м. на молекулу А, что соответствует 1,5 молекулам H2O.
А - K2CO3 1,5H2O. 1,5H2O.
Остатком от прокаливания активной магнезии является MgO (40,31 а.е.м.), независимо
от ее исходного состава. Потеря массы 70,88 % соответствует 0,7088  40,31/(1-0,7088) = 98,12 а.е.м. Нетрудно убедиться, что это число в точности
совпадает с суммой масс 1 молекулы СО2 и 3 молекул Н2О.
Б - MgCO3
40,31/(1-0,7088) = 98,12 а.е.м. Нетрудно убедиться, что это число в точности
совпадает с суммой масс 1 молекулы СО2 и 3 молекул Н2О.
Б - MgCO3 3H2O. 3H2O.
Двойная соль Энгеля, судя по названию может содержать карбонаты или гидрокарбонаты
калия и магния и, возможно, кристаллизационную воду. При нагревании до 200 оС
останется смесь карбонатов, до 700 оС - оксид магния и значительно
более устойчивый карбонат калия. В интервале от 200 до 700 оС разлагается
только карбонат магния. Доля СО2, приходящегося на карбонат магния
составляет 57,36 - 40,19 =17,17 % от исходной массы В и 17,17/(1-0,4019)=28,71
% от смеси карбонатов. Доля карбоната магния в этой смеси (44,05 + 40,31) 28,71/44,05
= 54,98 %, мольное отношение MgCO3/K2CO3 =
(54,98/84,36) : (45,02/138,21) = 2:1. Масса смеси состава 2MgCO3 28,71/44,05
= 54,98 %, мольное отношение MgCO3/K2CO3 =
(54,98/84,36) : (45,02/138,21) = 2:1. Масса смеси состава 2MgCO3 K2CO3
составляет 100 - 40,19 = 59,81 % от массы исходной соли Энгеля. На удаляющуюся
до 200 оС часть (вероятно, CO2 и H2O) приходится
40,19 K2CO3
составляет 100 - 40,19 = 59,81 % от массы исходной соли Энгеля. На удаляющуюся
до 200 оС часть (вероятно, CO2 и H2O) приходится
40,19  306,93/59,81 = 206,25 а.е.м. Рассчитаем
число молекул в смеси газов, приходящееся на эту массу (n = PV/RT). Из 10,00 г В получается 7,561 л газов, из 206,25
+ 306,93 = 513,18 г – 7,561 306,93/59,81 = 206,25 а.е.м. Рассчитаем
число молекул в смеси газов, приходящееся на эту массу (n = PV/RT). Из 10,00 г В получается 7,561 л газов, из 206,25
+ 306,93 = 513,18 г – 7,561 513,18/10,00 = 388,02
л, что составляет 388,02 513,18/10,00 = 388,02
л, что составляет 388,02 1/(0,082 1/(0,082 473,15)
= 10,00 моль. Решив нехитрую систему, получим, что потеря массы 206,25 а.е.м.
это одна молекула CO2 и 9 молекул H2O при остатке 2MgCO3 473,15)
= 10,00 моль. Решив нехитрую систему, получим, что потеря массы 206,25 а.е.м.
это одна молекула CO2 и 9 молекул H2O при остатке 2MgCO3 K2CO3.
Брутто-формула соли Энгеля K2Mg2(CO3)2(HCO3)2 K2CO3.
Брутто-формула соли Энгеля K2Mg2(CO3)2(HCO3)2 8H2O.
После сокращения всех коэффициентов на 2 получаем вполне приемлемую для двойной
соли формулу: В – KHCO3 8H2O.
После сокращения всех коэффициентов на 2 получаем вполне приемлемую для двойной
соли формулу: В – KHCO3 MgCO3 MgCO3 4H2O 4H2O
2. Уравнения реакций 1-4:
(1) 3(MgCO3 3H2O) + 2KCl +
CO2 = 2(KHCO3 3H2O) + 2KCl +
CO2 = 2(KHCO3 MgCO3 MgCO3 4H2O)Ї
+ MgCl2 4H2O)Ї
+ MgCl2
(2) 2(KHCO3 MgCO3 MgCO3 4H2O) 4H2O)
 K2CO3 + 2(MgCO3 K2CO3 + 2(MgCO3 3H2O)Ї+
3H2O + CO2 3H2O)Ї+
3H2O + CO2
(3) 2(KHCO3 MgCO3 MgCO3 4H2O)
+ Mg(OH)2 4H2O)
+ Mg(OH)2 K2CO3 + 3(MgCO3 K2CO3 + 3(MgCO3 3H2O)Ї
+ H2O 3H2O)Ї
+ H2O
(4) (CH3)3N + KCl + CO2 + H2O =
KHCO3Ї(Г) + (CH3)3NHCl
(Д)
Процесс 5 лучше проводить в насыщенном водном растворе, т.к. в этом случае разложение
гидрокарбоната калия идет при значительно более низкой температуре, чем в конденсированной
фазе. Самый экономичный способ перевода хлорида триметиламмония в исходный триметиламин
- слабое нагревание с гашеной известью:
(5) 2KHCO3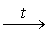 K2CO3 +
H2O + CO2 K2CO3 +
H2O + CO2
(6) 2(CH3)3NHCl + Ca(OH)2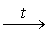 CaCl2
+ (CH3)3N CaCl2
+ (CH3)3N
3. Реакции 7-9:
(7) K2SO4 + Ca(OH)2 + 2CO = CaSO4Ї + 2HCOOK
(8) 2HCOOK + O2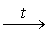 K2CO3 + H2O
+ CO2 K2CO3 + H2O
+ CO2
(9) K2SO4 + 2C + CaCO3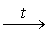 K2CO3 + CaS + 2CO2 K2CO3 + CaS + 2CO2
Процесс 8 проводят во вращающейся барабанной
печи, чтобы обеспечить доступ кислорода в зону
реакции. В обычной печи при недостатке кислорода
возможен и другой путь термолиза:
2HCOOK 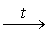 K2C2O4
+ H2 и K2С2О4 K2C2O4
+ H2 и K2С2О4 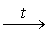 K2CO3
+ СО. K2CO3
+ СО.
В результате получается экологически
небезопасная смесь СО и Н2, а целевой
продукт будет загрязняться оксалатом калия. Тем
не менее, при соблюдении дополнительных мер
безопасности и увеличении времени
термообработки, можно обойтись и обычной печью.
4. В процессах Сольве и Леблана получают,
соответственно, гидрокарбонат и карбонат натрия.
Метод Леблана отличается от способа г) только
тем, что в нем используют сульфат натрия. В
производстве соды по Сольве в качестве основания
используют не триметиламин, а аммиак:
NaCl + CO2 + NH3 + H2O = NH4Cl + NaHCO3.
5. Нефелины относятся к классу алюмосиликатов,
фактически представляющих собой каркасную
структуру SiO2, часть атомов кремния в
которой замещена на атомы алюминия. Возникающий
в результате такой замены отрицательный заряд
компенсируется внешними катионами, в случае
нефелинов это в основном катионы калия и натрия
(приближенную среднюю формулу нефелинов часто
записывают как KNa3(AlSiO4)4). В
процессе комплексной переработки нефелинов
получают поташ, соду, цемент и окись алюминия, из
которой затем выделяют металлический алюминий.
Задача 10-5 (автор В.И. Теренин).
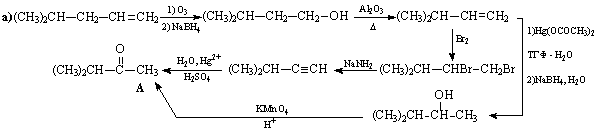
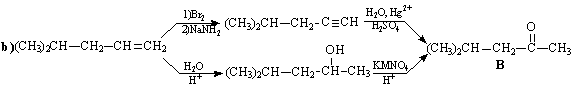
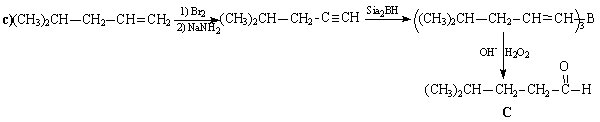
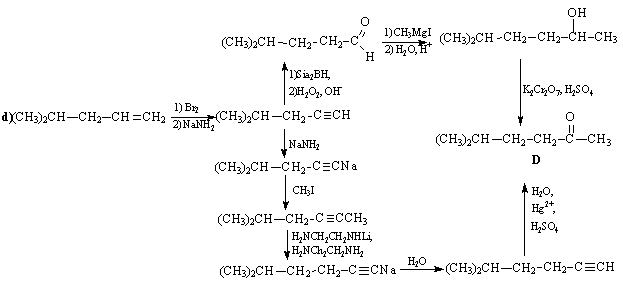
Задача 10-6 (автор Н.В.Копылов).
1. Из размерности константы скорости (с-1) следует, что реакция
имеет первый порядок.
2. Удобно представить уравнение Аррениуса в логарифмической форме
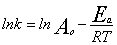
Тогда составив систему из двух уравнений, можно рассчитать 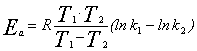 и затем найти Ао для каждого процесса.
и затем найти Ао для каждого процесса.
В результате, проводя попарные расчеты внутри интервала температур и получив
среднее значение, получим:
для 600-700К Еа » 213 кДж/моль ;Ао
= 4,5 109 109
для 900-975К Еа » 330 кДж/моль ;Ао
= 3,6 1016 1016
3. Вещество А это СО
5CO + I2O5 = I2 + 5CO2
Исходя из качественного состава (CF3)2CO
можно предположить, что B и C это CxFy.
Наиболее разумные варианты CF4,C2F2,C2F4
и C2F6. Молярные массы приведенных
фтороуглеродов равны 88, 62, 100 и 138 г/моль. Отношение
молярных масс, по условию задачи, как и отношение
плотности по воздуху, должно составлять 1.38.
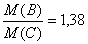
Этому условию удовлетворяет отношение
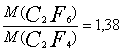
Таким образом, B - C2F6, C - C2F4
.Тогда D , дающий при гидролизе кислую среду, должен содержать кислород
и наиболее разумный вариант D – CF3C(O)F
При низких температурах (500-600К) пиролиз идет по уравнению (CF3)2CO
= C2F6 + CO
При T>900К преобладает реакция:
(CF3)2CO = C2F4 + 2 CF3COF
Гидролизсоединения D: CF3COF + H2O = CF3COOH
+ HF
4. Например, CF3CF2COONa
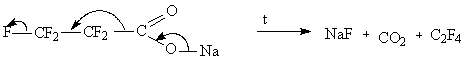
|

 экв(H2) =
экв(H2) = 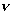 экв(Б)
= 0,07/11,2 =0,00625
экв(Б)
= 0,07/11,2 =0,00625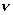 экв(Б) = 0,1/0,00625 = 16г/моль
экв(Б) = 0,1/0,00625 = 16г/моль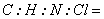

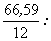
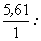
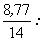
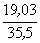
 = 5,55 : 5,61 : 0,66 :
0,54 ~ 10:10:1:1
= 5,55 : 5,61 : 0,66 :
0,54 ~ 10:10:1:1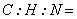
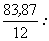
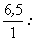
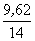 = 6,99 : 6,5 :0,69 = 10:9,4:1
= 6,99 : 6,5 :0,69 = 10:9,4:1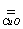 CаCl2 + N2 +10H2O
+20CaCO3
CаCl2 + N2 +10H2O
+20CaCO3


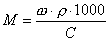 = 207,7
г/моль. С учетом трехосновности кислоты и наличия
в ней кислорода наиболее вероятная формула соли
Na3ЭО4. Тогда М(Na3ЭО4) = 69 +
А(Э) + 64 = 207,7, откуда А(Э) = 74,7 г/моль, что отвечает
мышьяку. Итак, H3AsO4 – мышьяковая
кислота.
= 207,7
г/моль. С учетом трехосновности кислоты и наличия
в ней кислорода наиболее вероятная формула соли
Na3ЭО4. Тогда М(Na3ЭО4) = 69 +
А(Э) + 64 = 207,7, откуда А(Э) = 74,7 г/моль, что отвечает
мышьяку. Итак, H3AsO4 – мышьяковая
кислота. HAsO42– + OH–
HAsO42– + OH–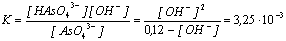
 HAsO42– + OH–
HAsO42– + OH– H3AsO4 + OH–
H3AsO4 + OH– НAsO42– + H3O+
НAsO42– + H3O+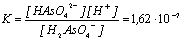 ,
, 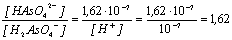
 K2CO3 + 2(MgCO3
K2CO3 + 2(MgCO3 K2CO3 +
H2O + CO2
K2CO3 +
H2O + CO2
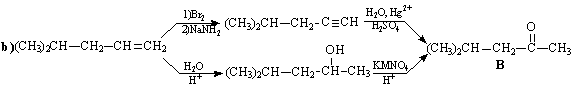
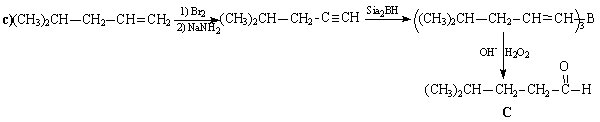

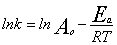
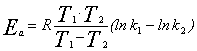 и затем найти Ао для каждого процесса.
и затем найти Ао для каждого процесса.