34ая Международная Химическая
Олимпиада
Гронинген, среда, 10 июля 2002 г.
Задание теоретического тура
Задача III-2. ГЛУТАТИОН – ВАЖНЫЙ ОЛИГОПЕПТИД
6 баллов
|
1a |
1b |
2a |
2b |
2c |
3 |
| Очки |
10 |
24 |
18 |
8 |
25 |
15 |
Глутатион (GSH) - олигопептид, присутствующий в
большинстве тканей животных. GSH выполняет важные
биологические функции, такие как детоксикация
электрофилов и восстановление (органических)
пероксидов в крови. Электрофильные соединения
необратимо реагируют с GSH, особенно в печени,
давая первичные продукты, которые через серию
биотрансформаций превращаются в так называемую меркаптуровую
кислоту, которая выводится с мочой. Окислители
реагируют с GSH, давая дисульфид GSSG, который может
быть превращен ферментами редуктазами обратно в
GSH. Соотношение GSH/GSSG в большинстве клеток e 500.
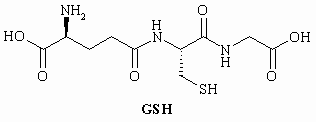
III-2-1 (a) Сколько аминокислотных остатков
присутствует в GSH?
(b) Нарисуйте структуры соответствующих
аминокислот и отметьте хиральные центры
звездочкой.

Меркаптуровая кислота A, выделенная из мочи
человека, подвергшегося воздействию
акрилонитрила (H2C=CH-CN), имеет брутто-формулу
C8H12N2O3S. 1H-ЯМР спектр A
в (CD3)2SO показан на рисунке 1. Если
образец предварительно обрабатывают D2O,
сигналы при 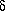 12.8 и
12.8 и 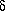 6.8 исчезают, а сигнал 3 упрощается.
6.8 исчезают, а сигнал 3 упрощается.
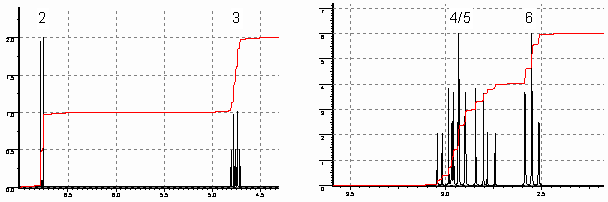

Рисунок 1.
III-2-2 (a) ЯМР сигналы соответствуют
протонам следующих групп: CH, CH2, CH3, OH и
NH. Впишите в рамки протоносодержащие группы,
соответствующие сигналам 1-7.

(b) Сколько атомов углерода, не связанных с
протонами, присутствует в соединении A?
(c) Изобразите структурную формулу A.

Витамин C (аскорбиновая кислота) реагирует с
окислителями, давая дегидроаскорбиновую кислоту
D
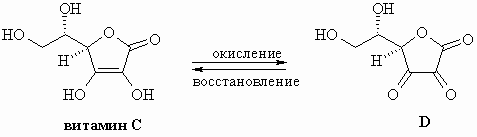
III-2-3 Употреблять в пищу свежие фрукты и овощи
полезно для здоровья
- Потому что витамин С образует комплекс с GSH.
- Потому что витамин С реагирует с
электрофильными соединениями.
- Потому что витамин С удаляет окислители и
предотвращает вредное уменьшение запасов GSH.
- По многим причинам, но ни одна из них не имеет
ничего общего с GSH.
Ответ дан в формате PDFы
Тема IV. СВЕТ И ЭНЕРГИЯ: ХИМИЧЕСКИЕ
АСПЕКТЫ
Химия играет главную роль в
удовлетворении наших потребностей в освещении и
энергии. Наша жизнь немыслима без источников
энергии.
Задача IV-1. ОСВЕТИТЕЛЬНЫЕ ЛАМПЫ
7 баллов
|
1 |
2 |
3 |
4 |
5 |
| Очки |
10 |
25 |
25 |
35 |
5 |
Начиная с 1891 г., в Нидерландах производят
осветительные лампы. Современные лампы, особенно
газоразрядные, несравненно совершеннее своих
ранних предшественников. В настоящее время в
производстве ламп используют соединения
редкоземельных металлов, такие, как CeBr3. Эти
соединения при комнатной температуре – ионные
кристаллы, а при нагревании они частично
сублимируются, образуя в парах нейтральные
молекулы галогенидов металлов. Для того чтобы
достичь возможно более высокого давления пара,
энтальпия сублимации должна быть как можно
меньшей.
IV-1-1 На основе закона Гесса запишите такой
термохимический цикл сублимации CeBr3 ,
который включает стадию образования одноатомных
ионов в газовой фазе. Используйте следующие
обозначения молярных энтальпий:
Hl - энтальпия образования кристалла из
газообразных ионов;
He - энтальпия электростатического
взаимодействия ионов в молекуле;
Hs - энтальпия сублимации.
Учтите, что Н – это не абсолютные значения, а  H.
H.
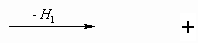
+
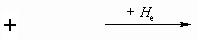

Энтальпию образования кристалла из
газообразных ионов можно рассчитать по формуле
Борна-Ланде:
Hl = f 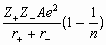 ,
,
где
множитель fe2 = 139, если ионные радиусы
измеряются в нм, а энергия в кДж. моль–1;
постоянная Маделунга для данного типа решетки A
= 2.985;
показатель Борна n = 11;
заряды ионов Z+ и Z– –
целые числа (Z– отрицательное
число).
Формулу Борна-Ланде можно применить и для
расчета энтальпии электростатического
взаимодействия ионов в молекулах CeBr3 и CsBr,
находящихся в газовой фазе. При этом постоянную А
надо исключить. Молекула CeBr3 – плоский
треугольник. Радиусы ионов: Ce3+ 0.115 нм, Br– 0.182
нм.
Ответ дан в формате PDF
IV-1-2 Рассчитайте энтальпию сублимации CeBr3
(все энтальпии округляйте до целых чисел; будьте
внимательны со знаками!)
Ответ дан в формате PDF и ваши вычисления
Для усовершенствования лампы в нее вносят CsBr в
стехиометрическом соотношении с CeBr3, что
при комнатной температуре ведет к образованию
кристаллического CsCeBr4. Срок эксплуатации
лампы растет с понижением температуры
сублимации. CsCeBr4 имеет решетку типа NaCl, с
катионами Cs+ и комплексными тетраэдрическими
анионами CeBr4–. Сублимация CsCeBr4
ведет к образованию в газовой фазе молекул CsBr и
CeBr3.
IV-1-3 На основе закона Гесса запишите
уравнения реакций термохимического цикла для
описанного выше процесса. Учтите, что в его
стадиях участвуют ионы CeBr4–,
одноатомные ионы и/или нейтральные молекулы в
газовой фазе.
Стадия 1: 
+
Стадия 2:
+
Стадия 3: 
+
Стадия 4: 
Общее уравнение:
Ответ дан в формате PDF
IV-1-4 Рассчитайте энтальпию сублимации CsCeBr4
(энтальпии округляйте до целых чисел). Применяйте
формулу Борна–Ланде для всех стадий процесса и
запишите результаты для всех стадий (будьте
внимательны к знакам!). Константа Маделунга для
решетки типа NaCl равна 1.75. Расстояние Cs–Ce в
кристаллической решетке равно 0.617 нм.
Комплексный анион CeBr4– – тетраэдр, в
котором отношение расстояний
"вершина-вершина"/"вершина-центр"
составляет (2.6)/3 = 1.633. Показатель Борна n для CsBr
равен 11. Радиус Cs+ составляет 0.181 нм.
Ответ дан в формате PDF для стадии 1: H1 = Ответ дан в формате PDF
Ваши расчеты:
Ответ дан в формате PDF для стадии 2: H2 = Ответ дан в формате PDF
Ваши расчеты:
Ответ дан в формате PDF для стадии 3: H3 = Ответ дан в формате PDF
Ваши расчеты:
Ответ дан в формате PDF для стадии 4: H4 = Ответ дан в формате PDF
Ваши расчеты:
Общая сумма: Htotal = Ответ дан в формате PDF
Ваши расчеты:
IV-1-5 Помогло ли добавление CsBr увеличить срок
эксплуатации лампы? Отметьте правильный ответ.
- Добавление CsBr вредно
- Добавление CsBr никак не влияет
- Добавление CsBr полезно
- Полученные данные не позволяют дать
однозначного ответа
Задача IV-2. КРАСНЫЙ РУБИН
5 баллов
|
1 |
2 |
3 |
4 |
5 |
| Очки |
20 |
20 |
20 |
20 |
20 |

Кристаллы рубина имеют темно-красный цвет. Он
обусловлен поглощением света ионами Cr3+,
которые включены в бесцветные кристаллы оксида
алюминия. Ион Cr3+ содержит 3 электрона на 3d
подуровне, и при поглощении света происходит
электронный переход между 3d орбиталями с
разной энергией.
IV-2-1 Укажите, какой из четырех спектров
поглощения принадлежит рубину.
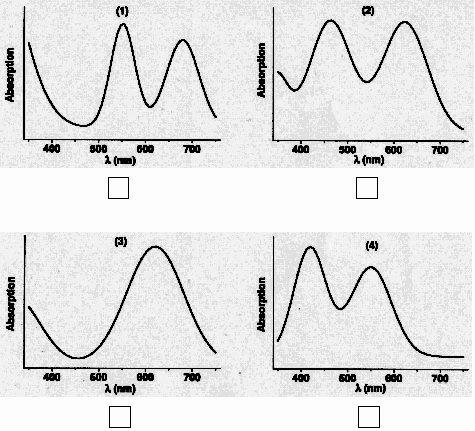
140
Рисунок 1
В рубиновых лазерах используется стержень,
который представляет собой цилиндр длиной 15.2 см
и диаметром 1.15 см. Массовая доля ионов Cr3+ в
стержне равна 0.0500 %. Плотность Al2O3 4.05 г.
см-3. Относительная атомная масса Cr = 52 а.е.м.
(1 а.е.м. = 1.67. 10-27 кг).
IV-2-2 Рассчитайте число штук ионов Cr3+ в
этом лазерном стержне.
Ответ дан в формате PDF
Ваши расчеты:
В рубинах ионы Cr3+ находятся в
октаэдрическом окружении из 6 ионов кислорода.
Ниже приведена форма пяти 3d орбиталей. Еще
ниже в большом прямоугольнике показано
расщепление пяти 3d орбиталей на группу из
трех орбиталей с более низкой энергией (t2g)
и группу из двух орбиталей (eg) с более
высокой энергией.
IV-2-3 В прямоугольниках под названиями 3d
орбиталей (dz2, dxy, dyz,
dx2-y2, dxz)
укажите, к какой группе – t2g или eg
– принадлежит каждая орбиталь.


IV-2-4 Покажите стрелками распределение по
орбиталям и направление спина для трех 3d
электронов Cr3+ в основном электронном
состоянии.

Кристалл рубина поместили на чашку
(немагнитных) весов. После того, как весы
уравновесили, прямо под чашку с рубином
поместили магнит (Рисунок 2).
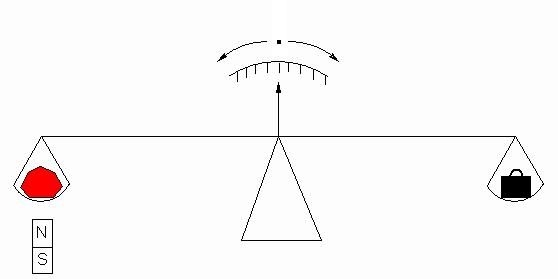
Рисунок 2.
IV-2-5 Укажите, что произойдет с рубином
(отметьте правильный ответ):
- Магнит притянет рубин (чашка с кристаллом
опустится вниз)
- С рубином ничего не произойдет (чашка с
кристаллом останется неподвижной)
- Магнит оттолкнет рубин (чашка с кристаллом
поднимется вверх)
- Магнит окажет осциллирующее действие на рубин
(чашка с весами будет двигаться то вверх, то вниз)
Ответ дан в формате PDF



