где a - боровский радиус (a0 = 5.3
1. Нормируйте данную волновую функцию.
2. Какое расстояние электрона от ядра наиболее вероятно?
б. Волновые функции 2s, 2pz и
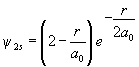

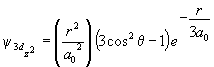
Задачи 6-10
Задача 6. Атомные и молекулярные орбитали
Задача 7. Деление ядер
Задача 8. Радиоактивный распад
Задача 9. Окислительно-восстановительные реакции
Задача 10. Растворимость труднорастворимых солей
Задача 6. Атомные и молекулярные орбитали
Орбитали - это одноэлектронные волновые функции, описывающие движение электронов в атоме (атомные орбитали), молекуле (молекулярные орбитали) или твердом теле. Каждая орбиталь описывает распределение вероятности нахождения электрона в разных областях пространства.
А. Атомные орбитали
а. 1s-орбиталь атома водорода имеет вид: ![]() ,
,
где a - боровский радиус (a0 = 5.3![]() 10-11 м), r - радиальная
координата (расстояние от точки в пространстве
до центра координат).
10-11 м), r - радиальная
координата (расстояние от точки в пространстве
до центра координат).
1. Нормируйте данную волновую функцию.
2. Какое расстояние электрона от ядра
наиболее вероятно?
б. Волновые функции 2s, 2pz и ![]() состояний имеют вид:
состояний имеют вид:
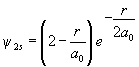

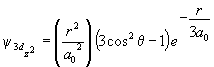
Нарисуйте узловые поверхности этих орбиталей.
в. Оказывается, решение уравнения Шредингера
для одноэлектронного атома в точности приводит к
"старой доброй" формуле Бора для
квантованной энергии:
![]() , где для удобства
постоянная величина дана с размерностью (эВ).
, где для удобства
постоянная величина дана с размерностью (эВ).
Возникает соблазн применить эту формулу к нейтральному атому гелия, однако это надо делать с осторожностью. В атоме гелия каждый электрон "чувствует" заряд ядра, экранированный другим электроном. Это означает, что эффективный заряд ядра, действующий на каждый электрон (обозначим этот заряд Zэфф), меньше, чем истинный заряд Z = 2. Экспериментальная энергия ионизации атома гелия в основном состоянии равна 24.46 эВ. Оцените Zэфф.
Б. Молекулярные орбитали
Молекулярные орбитали молекулярного иона водорода (H2+) можно приближенно представить как линейную комбинацию атомных орбиталей, центрированных на каждом из ядер молекулы. Рассмотрим (ненормированные) молекулярные орбитали, построенные из 1s и 2s-орбиталей двух атомов водорода, например A и B:
![]()
![]()
![]()
![]()
Если расположить ось z вдоль линии,
соединяющей ядра, то орбитальные контуры ![]() и
и ![]() имеют следующий вид:
имеют следующий вид:
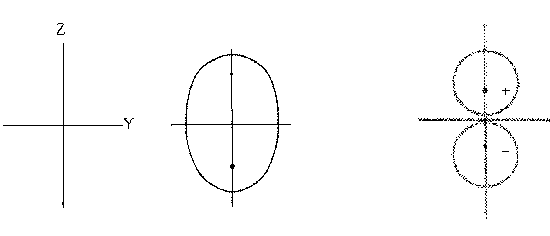
Аналогичные орбитальные контуры (т.е., кривые,
на которых y имеет постоянное значение) могут
быть изображены для ![]() и
и ![]() .
.
Зависимость энергии этих волновых функций от межъядерного расстояния приведена на рисунке:
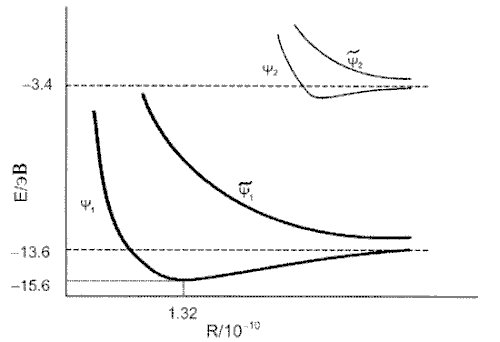
а. Укажите связывающие и разрыхляющие
орбитали. Объясните качественно, почему одни
орбитали - связывающие, а другие - разрыхляющие.
б. Определите равновесное межъядерное
расстояние Re и энергию диссоциации D
основного состояния H2+.
в. На какие атомные состояния диссоциирует
возбужденное состояние y 2 молекулярного
иона H2+?
При ответе на следующие вопросы можно допустить, что зависимость энергии от межъядерного расстояния в молекулах H2 и He2 такая же, как и в H2+.
г. Объясните, почему полный электронный
спин основного состояния нейтральной молекулы H2
равен нулю.
д. Напишите электронную конфигурацию первого
возбужденного состояния молекулы H2.
Предскажите, будет ли это состояние связанным
или распадным (несвязанным).
е. Молекулу He2 в основном состоянии
получить трудно, однако ее наблюдали в
возбужденных состояниях. Объясните, почему это
возможно.
Задача 7. Деление ядер
а. Рассмотрим следующие реакции деления 235U под действием медленных нейтронов:
![]()
![]()
Вставьте пропущенные частицы и числа.
б. Рассмотрим первую из указанных реакций.
Неустойчивые продукты деления подвергаются
серии ![]() -распадов, давая Zr и Ce.
Напишите суммарную ядерную реакцию и
рассчитайте выделившуюся энергию (в МэВ).
Используйте следующие значения атомных масс:
-распадов, давая Zr и Ce.
Напишите суммарную ядерную реакцию и
рассчитайте выделившуюся энергию (в МэВ).
Используйте следующие значения атомных масс:
m(235U) = 235.0493 а.е.м.
m(94Zr) = 93.9063 а.е.м.
m(140Ce) = 139.9054 а.е.м.
m(n) = 1.00866 а.е.м.
1 а.е.м. = 931.5 МэВ / c2
в. Один килограмм природного урана поместили
в исследовательский ядерный реактор. Когда
количество выделившейся энергии достигло 1 МВт![]() сут (МВс), образец вынули из
реактора. Чему равно содержание 235U в
полученном образце, если в природном уране оно
равно 0.72%? Результат, полученный в п. б, можно
рассматривать как среднюю энергию на один акт
деления. Считайте, что вся энергия выделяется
только при делении 235U.
сут (МВс), образец вынули из
реактора. Чему равно содержание 235U в
полученном образце, если в природном уране оно
равно 0.72%? Результат, полученный в п. б, можно
рассматривать как среднюю энергию на один акт
деления. Считайте, что вся энергия выделяется
только при делении 235U.
Задача 8. Радиоактивный распад
Радиоактивный изотоп 210Bi, который
является продуктом распада 210Pb, в
результате ![]() -распада
превращается в радиоактивный изотоп 210Po,
который испускает
-распада
превращается в радиоактивный изотоп 210Po,
который испускает ![]() -частицы и
превращается в стабильный 206Pb.
-частицы и
превращается в стабильный 206Pb.
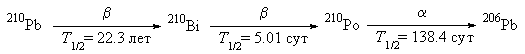
Образец радиохимически чистого 210Bi был
выделен из 210Pb и оставлен для накопления 210Po.
Радиоактивность свежеочищенного 210Bi
составила 100 мкКюри. (1 Кюри = 3.7![]() 1010
распадов в секунду.)
1010
распадов в секунду.)
а. Чему равна исходная масса образца 210Bi?
б. Рассчитайте время, через которое
количество 210Po в образце достигнет
максимального значения. Чему равно это значение?
в. Определите скорость ![]() -распада
210Po и
-распада
210Po и ![]() -распада 210Bi в
это время.
-распада 210Bi в
это время.
Задача 9. Окислительно-восстановительные
реакции
а. Раствор, содержащий ионы Sn2+, титруют
потенциометрически с Fe3+. Стандартные
электродные потенциалы для пар Sn4+/2+ и Fe3+/2+
равны:
Sn4+ + 2e = Sn2+, E0 = 0.154 В
Fe3+ + e = Fe2+, E0 = 0.771 В
1. Напишите суммарную
окислительно-восстановительную реакцию и
рассчитайте стандартное изменение энергии
Гиббса в реакции.
2. Определите константу равновесия реакции.
б. 20 мл 0.10 М раствора Sn2+ титруют 0.20 М
раствором Fe3+; рассчитайте напряжение в
цепи:
1. при добавлении 5 мл раствора Fe3+;
2. в точке эквивалентности;
3. при добавлении 30 мл раствора Fe3+.
В качестве стандартного электрода при
титровании используется насыщенный каломельный
электрод (E0 = 0.242 В).
в. Один из важных аналитических методов
определения Cu2+ - иодометрическое
титрование. В этой реакции Cu2+
восстанавливают ионом I- до Cu+, а
выделяющийся I2 титруют стандартным
раствором Na2S2O3.
Окислительно-восстановительная реакция имеет
вид:
2Cu2+ + 4I- ![]() 2CuI(тв)
+ I2(р-р)
2CuI(тв)
+ I2(р-р)
Стандартные электродные потенциалы для соответствующих полуреакций равны:
Cu2+ + e = Cu+, E0 = 0.153 В
I2 + 2e = 2I-, E0 = 0.535 В
Анализ электродных потенциалов показывает, что
восстановление Cu2+ ионом I- не может
протекать самопроизвольно. Однако, при
иодометрическом титровании эта реакции идет.
Разберемся, почему.
1. CuI плохо растворим в воде, ПР ![]() 1.1
1.1![]() 10-12.
Рассчитайте эффективное значение потенциала E
при равновесии CuI(тв) = Cu+ + I-.
10-12.
Рассчитайте эффективное значение потенциала E
при равновесии CuI(тв) = Cu+ + I-.
2. Используя результат, полученный в п. 1,
рассчитайте значение эдс для реакции
восстановления Cu2+ ионом I-. Какой
вывод о самопроизвольности реакции можно
сделать?
3.Рассчитайте константу равновесия для
реакции из п. 2.
Задача 10. Растворимость труднорастворимых солей
На растворимость труднорастворимых солей
влияют два важных вактора: pH и присутствие
комплексообразователя. Одна из таких солей -
оксалат серебра (растворимость в воде - 2.06![]() 10-4 при pH = 7.0). На его
растворимость сильно влияет pH, т.к. оксалат-ион
реагирует с ионами гидроксония, а также
комплексообразователи, такие как аммиак,
поскольку ион серебра образует с ними комплексы.
10-4 при pH = 7.0). На его
растворимость сильно влияет pH, т.к. оксалат-ион
реагирует с ионами гидроксония, а также
комплексообразователи, такие как аммиак,
поскольку ион серебра образует с ними комплексы.
а. Рассчитайте растворимость оксалата
серебра в подкисленной воде при pH = 5.0. Первая и
вторая константы диссоциации для щавелевой
кислоты равны 5.6![]() 10-2 и 6.2
10-2 и 6.2![]() 10-5, соответственно.
10-5, соответственно.
б. В водных растворах аммиака ион серебра
образует два комплекса: Ag(NH3)+ и Ag(NH3)2+.
Ступенчатые константы устойчивости этих
комплексов равны 1.59![]() 103 и 6.76
103 и 6.76![]() 103, соответственно.
Рассчитайте растворимость оксалата серебра в
водном растворе, содержащем 0.02 М NH3 и
имеющем pH = 10.8.
103, соответственно.
Рассчитайте растворимость оксалата серебра в
водном растворе, содержащем 0.02 М NH3 и
имеющем pH = 10.8.