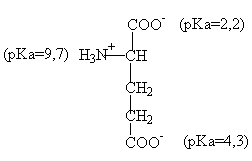
Задача 21. Аминокислоты и ферменты
Задача 22. Химия коферментов
Задача 23. Сворачивание белка
Задача 24. Секвенирование (определение
последовательности) белка
Задача 21. Аминокислоты и ферменты
Аминокислоты - это строительные блоки белков. Наличие -NН2 и -СООН групп обусловливает амфотерную природу аминокислот. Боковые цепи определенных аминокислот в белках исключительно важны для проявления их реакционной способности и каталитических свойств. Глутаминовая кислота является одной из таких аминокислот. Структурная формула глутаминовой кислоты приведена ниже:
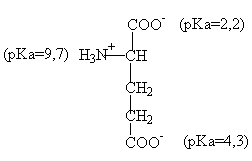
а. Почему значение рКа ![]() -СООН
группы ниже, чем
-СООН
группы ниже, чем ![]() -СООН группы?
-СООН группы?
б. Рассчитайте долю ![]() -СООН
групп, которые не ионизированы при рН 6.3.
-СООН
групп, которые не ионизированы при рН 6.3.
в. Глутаминовую кислоту подвергли
электрофорезу на бумаге при рН 3.25. В каком
направлении она будет двигаться: к аноду (+) или к
катоду (-). Почему?
Гидролиз полисахаридов, таких как хитин,
целлюлоза и пептидогликан - это распространенный
биохимический процесс. При этом гидролизуется
гликозидная связь, например ![]() -1,4
связь, изображенная ниже:
-1,4
связь, изображенная ниже:
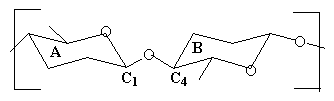
![]() -1,4 связь
-1,4 связь
Одна из реакций такого типа катализируется
ферментом лизоцимом.
г. Предположим, что реакция, катализируемая
лизоцимом, протекает в воде, обогащенной
изотопом 18О. Как Вы думаете, будет ли изотоп
18О входить в состав продукта реакции? Если
да, то в какой?
Профиль зависимости каталитической активности лизоцима от рН (рН-профиль) показан на графике:
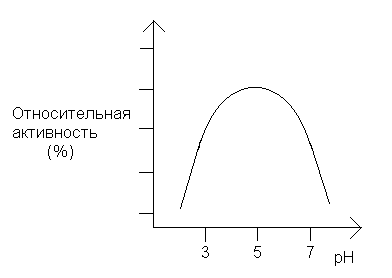
д. Объясните вид зависимости активности от рН, исходя из наличия в активном центре лизоцима двух карбоксильных групп (Asp-52 и Glu-35). Учтите, что ионогенные группы субстрата не оказывают влияния на вид зависимости. Напишите идеальное состояние ионизации активного центра лизоцима при рН 5.0.
е. Значение рКа Glu-35 в активном центре лизоцима составляет 6,0, а не 4,3 (как для свободной аминокислоты). Какой из следующих эффектов микроокружения группы приводит к такому изменению значения рКа?
Для прояснения механизмов ферментативного катализа были с успехом использованы модельные органические реакции. Когда реакция протекает внутримолекулярно (как в случае ферментов!), наблюдается увеличение скорости (как будто кажущаяся концентрация реагентов в реакционном участке существенно повышена). Были изучены реакции гидролиза трех фенилацетатов, катализируемые карбоксильной группой. Формулы и значения констант скорости (k) приведены ниже.
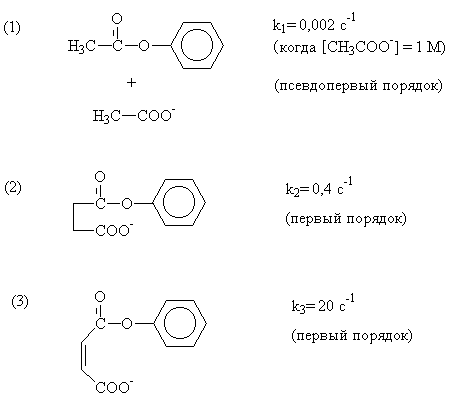
ж. Рассчитайте эффективную локальную
концентрацию СОО--групп для случаев (2) и (3),
приведенных выше.
з. Почему в случае (3) скорость выше, чем в
случае (2)?
Задача 22. Химия коферментов
Защитная внешняя клеточная стенка бактерий содержит D-аланин в качестве одного из строительных блоков. Однако в результате метаболических процессов образуются только L-аминокислоты. Бактерия образует D-аланин, осуществляя реакцию изомеризации L-аланина. Структурная формула L-аланина имеет вид:
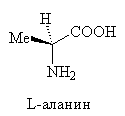
Удаление ![]() -протона из L-аланина
и последующее протонирование карбаниона с
противоположной стороны кажется простым
процессом. Однако депротонировать аланин
непросто, если его NH2-группа не
замаскирована, а связь С
-протона из L-аланина
и последующее протонирование карбаниона с
противоположной стороны кажется простым
процессом. Однако депротонировать аланин
непросто, если его NH2-группа не
замаскирована, а связь С![]() -Н не
активирована, как в кислоте.
-Н не
активирована, как в кислоте.
Оба эти процесса осуществляются коферментом пиридоксальфосфатом (PLP) в присутствии фермента аланинрацемазы. Приведенные ниже данные, полученные для модельных реакций, помогут Вам понять роль кофермента PLP.
При благоприятных экспериментальных условиях
бензальдегид может быть использован для
рацемизации аланина. Другими словами,
бензальдегид может маскировать аминогруппу и
активировать связь С![]() -Н аланина,
делая его более кислым.
-Н аланина,
делая его более кислым.
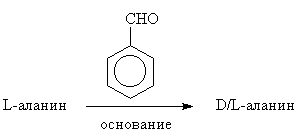
а. Предложите постадийный механизм для катализируемой основанием рацемизации L-аланина, включающий бензальдегид в качестве реагента.
PLP - более сложная молекула, чем бензальдегид, При помощи ряда тщательно выбранных ароматических альдегидов можно получить хорошее представление о роли кофермента PLP. Структурные формулы некоторых подобных соединений приведены ниже. Под каждым из них указана их активность.
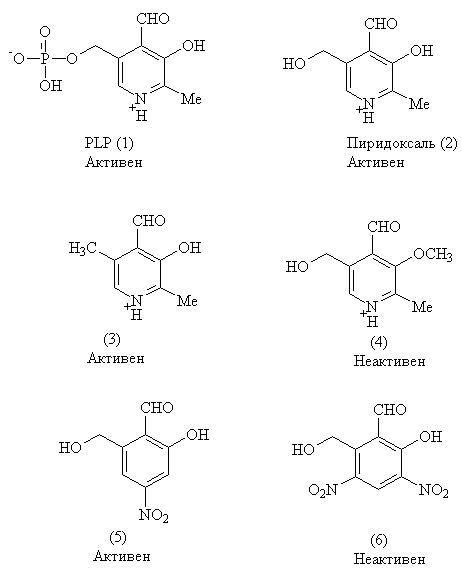
б. Используя эту информацию, какие можно сделать выводы о требованиях к структуре PLP, чтобы он действовал как кофермент?
в. Для того, чтобы любое из приведенных выше соединений проявляло PLP-подобную активность в отсутствие фермента, необходим ион трехвалентного металла. Предложите объяснение роли металла.
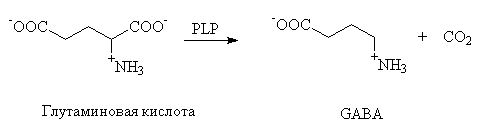
г. PLP - весьма универсальный кофермент. Он
участвует в разнообразных биологически важных
реакциях. При этом активность PLP реализуется
благодаря тому, что он выступает акцептором
электронов, стабилизирующим карбанионы. Важным
примером каталитической универсальности PLP
является биосинтез нейромедиатора ![]() -аминомасляной кислоты (GABA). Как
показано ниже, GABA получается в одну стадию из
L-глутаминовой кислоты. Предложите механизм,
объясняющий роль PLP как кофермента в приведенной
ниже реакции:
-аминомасляной кислоты (GABA). Как
показано ниже, GABA получается в одну стадию из
L-глутаминовой кислоты. Предложите механизм,
объясняющий роль PLP как кофермента в приведенной
ниже реакции:
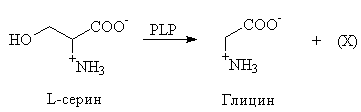
д. В еще одной реакции, протекающей с участием PLP, L-серин выступает одноуглеродным донором в сложном процессе биосинтеза нуклеотида. Фермент серингидроксиметилтрансфераза при помощи PLP превращает L-серин в более простую аминокислоту глицин. В качестве побочного продукта данной реакции образуется метаболически важное промежуточное соединение (Х). Из анализа механизма, основанного на действии PLP, определите соединение (Х).
Задача 23. Сворачивание белка
Взаимосвязь между аминокислотной последовательностью белка (первичной структурой) и его точной трехмерной структурой (третичной структурой) остается одной из наиболее важных нерешенных загадок современной науки.
Остовы всех белков идентичны: плоские амидные
звенья соединены тетраэдрическими метиленовыми
мостиками, так называемыми ![]() -углеродами.
С каждым
-углеродами.
С каждым ![]() -углеродом связан
боковой радикал R соответствующей аминокислоты
(см. Диаграмму ниже).
-углеродом связан
боковой радикал R соответствующей аминокислоты
(см. Диаграмму ниже).
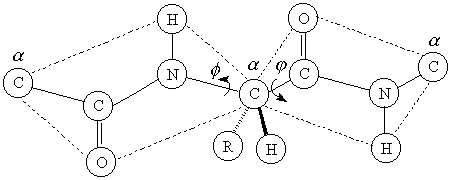
Уникальная последовательность аминокислот
характеризует каждый отдельно взятый белок,
определяя, как он сворачивается и функционирует.
а. Каждая амидная группа в полипептидном
остове, включая ![]() -углеродные
атомы, является плоской. Объясните, почему.
-углеродные
атомы, является плоской. Объясните, почему.
б. ![]() -Углеродные атомы у
каждого амидного звена оказываются в
транс-конформации. Однако, в случае одной
аминокислоты - пролина - как цис-, так и
транс-конформации почти одинаково вероятны.
Почему?
-Углеродные атомы у
каждого амидного звена оказываются в
транс-конформации. Однако, в случае одной
аминокислоты - пролина - как цис-, так и
транс-конформации почти одинаково вероятны.
Почему?
в. Конформационная свобода остатков
аминокислот в полипептидной цепи контролируется
стехиометрически. Для 19 генетически кодируемых
аминокислот конформационная свобода почти
полностью ограничена областями ![]() (свернутой) и
(свернутой) и ![]() (расширенной) на
диаграмме Рамачандрана. Однако для аминокислоты
глицин конформационная свобода гораздо шире.
Объясните, почему.
(расширенной) на
диаграмме Рамачандрана. Однако для аминокислоты
глицин конформационная свобода гораздо шире.
Объясните, почему.
г. Когда линейный полипептид сворачивается,
образуя глобулярный белок, остаток аминокислоты
может оказаться в ![]() или
или ![]() конформации. Однако наблюдения
показывают, что следующие друг за другом остатки
обычно оказываются либо все в
конформации. Однако наблюдения
показывают, что следующие друг за другом остатки
обычно оказываются либо все в ![]() ,
либо все в
,
либо все в ![]() конформации, а не в
статистической комбинации
конформации, а не в
статистической комбинации ![]() и
и ![]() . Объясните, почему.
. Объясните, почему.
д. В водной среде полипептиды, как правило,
сворачиваются в компактные глобулярные белковые
структуры. Выберите причину этого явления:
Обоснуйте свой выбор.
е. Полярность боковых радикалов R играет
важную роль при определении того, в какую
структуру - ![]() -спираль или
-спираль или ![]() -лист - свернется полипептид в воде
или на неполярной поверхности. Объясните роль
полярности боковых радикалов R.
-лист - свернется полипептид в воде
или на неполярной поверхности. Объясните роль
полярности боковых радикалов R.
Задача 24. Секвенирование (определение последовательности) белка
Секвенирование белка (полипептида) включает
следующие этапы:
а) очистку белка;
б) определение N-концевой аминокислоты;
в) расщепление полипептидной цепи химическими и
ферментативными способами;
г) выделение пептидных фрагментов; д) определение
последовательности фрагментов при помощи
автоматического секвенирующего прибора
(секвенатора).
Можно также секвенировать смесь пептидных
фрагментов, не разделяя ее.
Окончательно последовательность аминокислот в белке устанавливается путем подбора пересекающихся последовательностей после получения информации о положении аминокислот в различных фрагментах.
Небольшой белок, состоящий из 40 аминокислотных остатков, подвергли секвенированию следующим образом:
Используя данную информацию:
а. Определите аминокислотную
последовательность, общую для первых (ближайших
к N-концу) фрагментов, полученных обработкой
белка CNBr и трипсином.
б. Определите последовательность первого
фрагмента, полученного обработкой CNBr.
в. Выведите полную последовательность
исходного белка. Укажите места, на которые
действуют CNBr и трипсин.
г. Какого процентное содержание (от общего
числа аминокислотных остатков) основных
аминокислотных остатков?
д. Если бы данный полипептид существовал в
виде ![]() -спирали, какова бы была
длина данной
-спирали, какова бы была
длина данной ![]() -спиральной
структуры?
-спиральной
структуры?
Таблица 1. Данные, полученные при помощи автоматического секвенатора.
Метод |
Номер позиции |
|||||||
обработки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| А) CNBr: (Met) |
Arg Asp Glu Gly |
Gln Pro Thr Tyr |
Asn Pro Ser Tyr |
Arg His Ile Val |
Asn Ile Leu Phe |
Arg His Trp Val |
Ala Gly Phe Thr |
Ala Lys Met Tyr |
| Б) Трипсин: (Arg или Lys) |
Asp Gly Gly Phe Tyr |
Cys His Pro Pro Tyr |
His Met Thr Tyr |
Ala Asn Glu Val |
Ile Leu Thr Trp |
Arg Phe Ser Ser |
Cys Lys Ile |
Glu Leu |
е. Каков размер фрагмента ДНК (экзона),
кодирующего такой полипептид из 40 аминокислот?
Приведите размер в количестве пар оснований и в
дальтонах (считайте, что средняя молекулярная
масса нуклеотида в ДНК составляет 330).
ж. Допуская, что в ДНК, соответствующей
данному экзону, число Аденинов равно числу
Цитозинов, рассчитайте число водородных связей,
которые будут реализованы в данной двойной
спирали.