| ClO2 + NaOH |
( ) |
+ |
( ) | + H2O |
| X | Y |
33 МХО Задача 5
Химия галогенов
В реакциях между собой и с другими веществами галогены образуют большое число соединений с различной структурой, типом химической связи и химическими свойствами. Галогениды металлов, галогенопроизводные и интергалогениды представляют собой основные типы соединений галогенов.
(A) Фотография
Черно-белая фотопленка состоит из эмульсии, содержащей бромид серебра, которая нанесена на подложку из ацетата целлюлозы.
5.1 Запишите уравнение фотохимической реакции, протекающей при освещении эмульсии с AgBr(тв).
5.2 Неэкспонированные кристаллы AgBr удаляют путем обработки пленки раствором тиосульфата натрия за счет комплексообразования с Ag (I). Запишите уравнение соответствующей реакции.
5.3.Полученные растворы часто считают отходами. Однако, путем добавления к такому раствору сначала цианида, а затем металлического цинка можно выделить металлическое серебро. Запишите уравнения соответствующих реакций.
(B) Форма молекул, спектры и реакционная способность
Наиболее активный галоген – фтор – реагирует при определенных условиях с остальными галогенами Cl2, Br2, и I2 с образованием соединений, состоящих из четырех, шести и восьми атомов, соответственно.
5.4 Запишите формулы и изобразите пространственную структуру трех таких интергалогенидов с точки зрения теории отталкивания электронных пар. Покажите расположение неподеленных электронных пар центрального атома там, где это необходимо.
Смесь паров иода и газообразного хлора при введении в масс-спектрометр дает два набора (А и В) пиков со следующими значениями m/z:
A : (162; 164)
B : (464; 466; 468; 470; 472; 474; 476)
5.5 Идентифицируйте молекулярные частицы, которым соответствуют пики с m/z = 162, 164, 466 и 476. Изобразите структуру самой тяжелой частицы (m/z = 476), четко указав положение неподеленных электронных пар у атома (или атомов) иода. Укажите изотопный состав каждой из молекулярных частиц.
В водном растворе газообразный хлор окисляет тиосульфат-ион до иона, содержащего серу в максимальной степени окисления.
5.6. Запишите сокращенное ионное уравнение
этой реакции.
5.7. Изобразите формулу Льюиса для
тиосульфат-иона. Отметьте тот атом серы, который
имеет более низкую степень окисления.
5.8 Диоксид хлора реагирует с гидроксидом
натрия по схеме, показанной ниже. Впишите формулы
хлорсодержащих продуктов Х и Y и расставьте
коэффициенты в уравнении.
| ClO2 + NaOH |
( ) |
+ |
( ) | + H2O |
| X | Y |
5.9 Хлор используется для производства хлорной извести. Запишите уравнение реакции получения хлорной извести.
5.10 Определите степени окисления атомов хлора в основном веществе хлорной извести.
(C) Галогениды щелочных металлов и рентгеновская кристаллография
Рентгеновская кристаллография позволяет определить многие особенности кристаллической структуры галогенидов металлов. Отношение радиусов катиона и аниона (r+/r- ) –удобный параметр, позволяющий объяснять структуру и ее устойчивость. Ниже в таблице приведены отношения радиусов (r+/r- ) для некоторых галогенидов щелочных металлов. На рисунке схематически показана зависимость электростатической компоненты энергии кристаллической решетки щелочных галогенидов от величины отношения радиусов (для постоянного r- ) для структурных типов NaCl и CsCl.
Li+ |
Na+ |
K+ |
Rb+ |
Cs+ |
|
Cl- |
0.33 |
0.52 |
0.74 |
0.82 |
0.93 |
Br- |
0.31 |
0.49 |
0.68 |
0.76 |
0.87 |
I- |
0.28 |
0.44 |
0.62 |
0.69 |
0.78 |
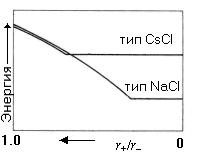
5.11.При одинаковом анионе горизонтальный участок графика для структурного типа NaCl располагается ниже, чем для структурного типа CsCl при малых величинах r+/r - из-за:
(а) |
контакта катиона с катионом вдоль диагонали грани |
(б) |
контакта аниона с анионом вдоль диагонали грани |
(в) |
контакта катиона с анионом вдоль ребра ячейки |
Выберите правильный ответ.
5.12 Для какого из галогенидов – LiBr, NaBr или RbBr – максимальна вероятность фазового превращения из структурного типа NaCl в тип CsCl при изменении температуры и/или давления?
5.13 Рассчитайте отношение радиусов (r+/r- ), при котором электростатическая компонента энергии решетки для структурного типа CsCl выходит на горизонтальный участок.
5.14 При использовании Cu-Ka излучения (![]() = 154
пм) дифракция кристаллов KCl (имеющих кубическую
гранецентрированную структуру) наблюдается при
угле q= 14.2. Рассчитайте постоянную решетки а
для KCl, учитывая, что:
= 154
пм) дифракция кристаллов KCl (имеющих кубическую
гранецентрированную структуру) наблюдается при
угле q= 14.2. Рассчитайте постоянную решетки а
для KCl, учитывая, что:
(1) дифракция наблюдается от плоскостей с h2 + k2 + l2 = 4
(2) для кубического кристалла dhkl = a / (h2 + k2 + l2)1/2, где d – расстояние между соседними hkl-плоскостями, a – постоянная решетки
(3) отражения для кубической гранецентрированной решетки наблюдаются от плоскостей только со всеми нечетными или только со всеми четными hkl индексами. 5.15.Укажите в приведенной ниже таблице соответствующие значения для второй и третьей координационной сферы иона K+ в решетке KCl .
2ая координационная сфера |
3я координационная сфера |
||||
число |
знак заряда иона |
радиус |
число |
знак заряда иона |
радиус |
| - | - | - | - | - | - |
5.16 Рассчитайте минимально возможное значение дифракционного угла q для структуры KCl.
33 МХО Задача 6
Органическая химия индийских специй
В традиционной индийской медицине различные препараты на основе имбиря используются для лечения разных заболеваний. Специфические свойства имбиря обусловливаются рядом веществ, многие из которых представляют собой замещенные ароматические соединения с различными боковыми цепями. Особенно важны три таких соединения: Цингерон, (+)[6] Гингерол (далее обозначается просто Гингерол) и Шогаол.
Цингерон C11H14O3
Гингерол C17H26O4
Шогаол C17H24O3
6.1 Цингерон дает положительную реакцию с FeCl 3 и 2,4-DNP (2,4-динитрофенилгидразином), но не реагирует с реактивом Толленса. Определите, какие из перечисленных ниже функциональных групп содержит Цингерон:
| (а)спиртовой гидроксил | (д)сложный эфир |
| (б)альдегидный карбонил | (е)алкоксил |
| (в)кетонный карбонил | (ж)ненасыщенную связь |
| (г)фенольный гидроксил | - |
Данные, полученные из 1H ЯМР спектра
Цингерона, приведены в Табл 1.
Другая важная информация дана в Таблице 2.
Таблица 1. Данные из 1H ЯМР спектра Цингерона
Хим. сдвиги (
|
Мультиплетность |
Относительная интенсивность |
| 2.04 | синглет | 3 |
| 2.69; 2.71 | два близкорасположенных триплета равной интенсивности | 4 |
| 3.81 | синглет | 3 |
| 5.90 | широкий синглет (способен к обмену в D2O) | 1 |
| 6.4 – 6.8 | два дублета с одинаковым химическим сдвигом и один синглет | 3 |
Таблица 2. Приблизительные 1H химические
сдвиги (![]() ) и константы спин-спинового
взаимодействия (J) для некоторых типов
протонов.
) и константы спин-спинового
взаимодействия (J) для некоторых типов
протонов.
1H Химические сдвиги (![]() )
)
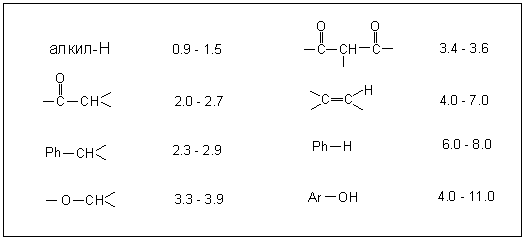
Константы спин-спинового взаимодействия (J)
| Алкены | цис- |
5 – 14 Гц (обычно порядка 6 – 8 Гц) |
транс- |
11 – 19 Гц (обычно порядка 14 – 16 Гц) |
При реакции Цингерона с бромной водой образуется только один продукт, монобромированный по бензольному кольцу. Анализ ИК-спектра Цингерона показывает наличие слабой внутримолекулярной водородной связи, которая сохраняется даже после восстановления Цингерона по Клемменсену (Zn–Hg/HCl).
6.2. Исходя из приведенной выше информации,
напишите :
1.боковую цепь Цингерона
2.остальные заместители в бензольном кольце
3.относительное расположение заместителей в
кольце (цифрами)
6.3 Изобразите возможную структуру Цингерона на основании сделанных выше выводов.
6.4 Заполните ячейки структурными формулами для последовательности реакций синтеза Цингерона.
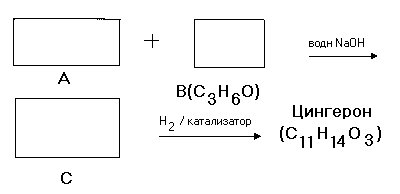
6.5 Из Цингерона можно легко получить Гингерол в результате следующих реакций :
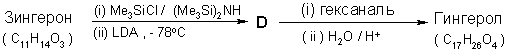
Примечания : (1) Me3SiCl / (Me3Si)2NH
используется для превращения OH в -OSiMe3;
группу -SiMe3 можно удалить кислотным
гидролизом.
(2) LDA – диизопропиламид лития, являющийся
сильным, стерически затрудненным
ненуклеофильным основанием.
i.Изобразите структуру D.
ii. Изобразите структуру Гингерола.
iii.Изобразите проекцию Фишера для R-энантиомера
Гингерола.
iv.В результате приведенной выше
последовательности реакций (пункт 6.5)
образуется 2 – 3% соединения (E), которое
является изомером Гингерола. Изобразите
структуру E.
v.Соединение E будет образовываться как
а)пара энантиомеров
б)смесь диастереомеров
в)смесь энантиомерной пары и мезо-изомера
Выберите правильный ответ.
vi.При нагревании Гингерола (C17H26O4)
с умеренной кислотой (такой как KHSO4)
образуется Шогаол (C17H24O3).
Изобразите структуру Шогаола.
6.6.Турмерик (Curcuma longa) широко используется как приправа в индийской кухне. Он также променяется в традиционной 21H20O6, являющийся активным компонентом турмерика, структурно подобен Гингеролу. Ему присуща кето-енольная таутомерия. Куркумин обуславливает желтую окраску турмерика и его острый вкус.
1H ЯМР спектре кето-формы Куркумина
присутствуют ароматические сигналы, похожие на
ароматические сигналы Гингерола. Помимо этого, в
спектре Куркумина присутствуют синглет около ![]() 3.5
(2H) и два дублета (2Н каждый) в районе
3.5
(2H) и два дублета (2Н каждый) в районе ![]() 6–7,
для которых J = 16 Hz. Куркумин может
быть синтезирован конденсацией двух молей
соединения А (см.пункт 6.4) с одним молем
пентан-2,4-диона.
6–7,
для которых J = 16 Hz. Куркумин может
быть синтезирован конденсацией двух молей
соединения А (см.пункт 6.4) с одним молем
пентан-2,4-диона.
i.Изобразите стереохимическую структуру
Куркумина
ii.Изобразите структуру енольной формы
Куркумина iii.Куркумин имеет желтый цвет, потому
что он содержит:
(а)бензольное кольцо
(б)карбонильную группу
(в)протяженную систему сопряженных связей
(г)гидроксильную группу
Выберите правильный ответ.
33 МХО Задача 7
Пептиды и белки
Сворачивание белков
Полипептидный остов белков может принимать
разнообразные конформации. В одних конформациях
полипептидный остов полностью растянут (как,
например, в параллельном или анти-параллельном
![]() -листе).
В других конформациях полипептидный остов
полностью скручен (как, например, в
-листе).
В других конформациях полипептидный остов
полностью скручен (как, например, в ![]() -спирали).
-спирали).
7.1Расстояние между концами гексапептида,
когда он полностью растянут, составляет
приблизительно:
(а) 10 А
(б) 15А
(в) 20А
(г) 25А
Выберите правильный ответ.
Аминокислота |
Структура |
Молекулярная масса (Da) |
| Glu – глутаминовая кислота | 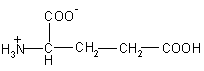 |
147 |
| Hms – гомосерин | 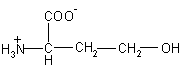 |
119 |
| Leu – лейцин | 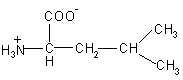 |
131 |
| Met – метионин
|
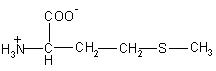 |
149 |
| Lys – лизин
|
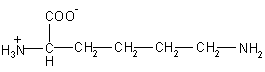 |
146 |
| Phe – фенилаланин | 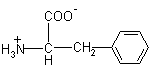 |
165 |
| Arg – аргинин
|
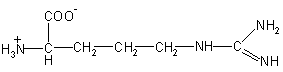 |
174 |
| Ser – серин>
|
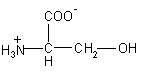 |
105 |
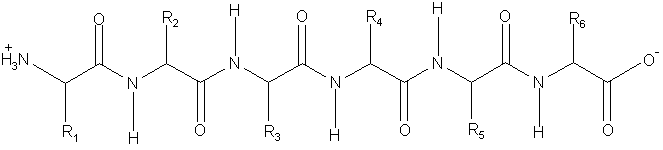
7.2. В рамке ниже приведен гексапептид. Предполагая, что он существует в a–спиральной конформации, соедините линией с двумя стрелками атом кислорода и амидную NH-группу, между которыми образуется водородная связь.
 7.3. Конформации
двух гексапептидов (A и B), приведенных
ниже в рамке, различаются в воде при рН 7.0.
Различие становится еще значительнее после того,
как гидроксилы их серинов подвергаются
фосфорилированию. Изначально A умеренно
спирализован, а после фосфорилирования серина
спирализация A значительно усиливается.
Изначально B линиями со стрелками
аминокислотные остатки, взаимодействие между
которыми обусловливает различие в поведении
данных гексапептидов А и В.
7.3. Конформации
двух гексапептидов (A и B), приведенных
ниже в рамке, различаются в воде при рН 7.0.
Различие становится еще значительнее после того,
как гидроксилы их серинов подвергаются
фосфорилированию. Изначально A умеренно
спирализован, а после фосфорилирования серина
спирализация A значительно усиливается.
Изначально B линиями со стрелками
аминокислотные остатки, взаимодействие между
которыми обусловливает различие в поведении
данных гексапептидов А и В.
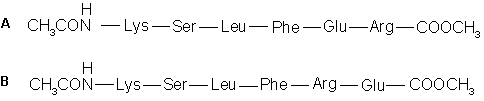
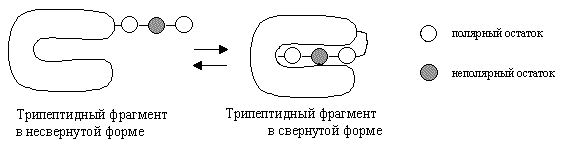
Рассмотрим процесс
сворачивания/разворачивания трипептидного
фрагмента в большом белке. Изменение свободной
энергии ( ![]() G ) зависит от взаимодействия
несвернутого трипептида с растворителем (водой)
и взаимодействия трипептида с остальной частью
белка в свернутом состоянии (см. ниже).
Предположим, что трипептид состоит из одного
неполярного (гидрофобного) и двух полярных
(гидрофильных) остатков. Предположим, что
изменение свободной энергии взаимодействия для
следующих случаев приблизительно равно:
G ) зависит от взаимодействия
несвернутого трипептида с растворителем (водой)
и взаимодействия трипептида с остальной частью
белка в свернутом состоянии (см. ниже).
Предположим, что трипептид состоит из одного
неполярного (гидрофобного) и двух полярных
(гидрофильных) остатков. Предположим, что
изменение свободной энергии взаимодействия для
следующих случаев приблизительно равно:
(1) неполярный остаток и растворитель (вода)
![]() G =
+8 кДж/моль
G =
+8 кДж/моль
(2).неполярный остаток и остальная часть белка
![]() G =
-4 кДж/моль
G =
-4 кДж/моль
(3). полярный остаток и растворитель (вода)
![]() G =
- 16 кДж/моль
G =
- 16 кДж/моль
(4).полярный остаток и остальная часть белка
![]() G =
- 14 кДж/моль
G =
- 14 кДж/моль
7.4. Рассчитайте ![]() G перехода трипептида из
несвернутого в свернутое состояние.
G перехода трипептида из
несвернутого в свернутое состояние.
7.5Рассчитайте ![]() G перехода трипептида из
несвернутого в свернутое состояние для случая,
когда все три остатка трипептида полярные.
G перехода трипептида из
несвернутого в свернутое состояние для случая,
когда все три остатка трипептида полярные.
![]() -Лактамаза и устойчивость к
лекарствам
-Лактамаза и устойчивость к
лекарствам
Пенициллины эффективны при борьбе с
бактериальными инфекциями. Однако в последние
годы появились бактерии, устойчивые к этому
лекарству. Устойчивость к пенициллину
появляется в результате образования фермента ![]() -лактамазы (также известного как пенициллиназа).
Данный фермент инактивирует пенициллин,
раскрывая его
-лактамазы (также известного как пенициллиназа).
Данный фермент инактивирует пенициллин,
раскрывая его ![]() -лактамное кольцо. Механизм
такого раскрытия b> -лактамного кольца включает
нуклеофильную атаку –OH группой серина в
активном центре фермента как изображено ниже
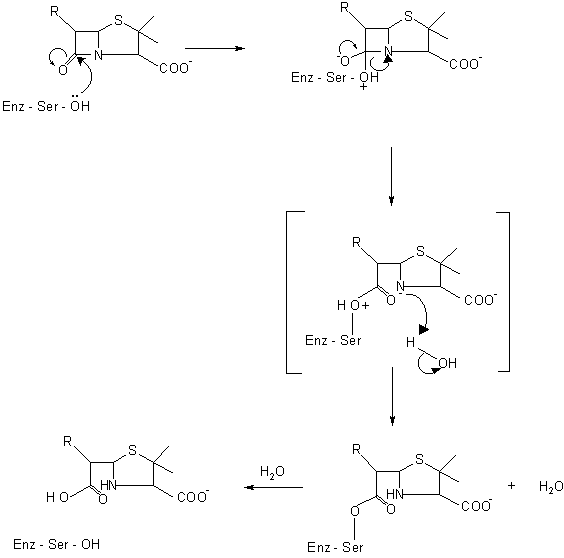
("Enz" на схемах обозначает "фермент").
-лактамное кольцо. Механизм
такого раскрытия b> -лактамного кольца включает
нуклеофильную атаку –OH группой серина в
активном центре фермента как изображено ниже
("Enz" на схемах обозначает "фермент").
Была предпринята попытка охарактеризовать ![]() -лактамазу из Staphylococcus aureus , для чего чистый
фермент обработали радиоактивно меченым 32P-фосфорилирующим
агентом. При этом оказался помеченным только
серин активного центра. Анализ показал, что на
данный серин {молекулярная масса = 105 массовых
единиц (Da)} приходится 0.35 мас.%
-лактамазу из Staphylococcus aureus , для чего чистый
фермент обработали радиоактивно меченым 32P-фосфорилирующим
агентом. При этом оказался помеченным только
серин активного центра. Анализ показал, что на
данный серин {молекулярная масса = 105 массовых
единиц (Da)} приходится 0.35 мас.% ![]() -лактамазы.
-лактамазы.
7.6.Оцените минимальную молекулярную массу
данной ![]() –лактамазы.
–лактамазы.
7.7.Приблизительное количество
аминокислотных остатков в типичном белке такой
молекулярной массы составляет :
(а) 100
(б) 150
(в) 275
(г) 375
Выберите правильный ответ.
7.8 Для выявления аминокислотных остатков в
активном центре, ![]() -лактамаза была
гидролизована высокоспецифичным ферментом
трипсином. В результате был выделен гексапептид
P1, содержащий серин из активного центра.
Аминокислотный анализ показал, что в Р1
содержатся в эквимолярном количестве следующие
аминокислотные остатки: Glu, Leu, Lys, Met, Phe и Ser.
-лактамаза была
гидролизована высокоспецифичным ферментом
трипсином. В результате был выделен гексапептид
P1, содержащий серин из активного центра.
Аминокислотный анализ показал, что в Р1
содержатся в эквимолярном количестве следующие
аминокислотные остатки: Glu, Leu, Lys, Met, Phe и Ser.
В результате обработки P1 реактивом Эдмана (фенилизотиоцианат) образовались фенилтиогидантоинное (PTH) производное фенилаланина и пептид P2.
В результате обработки P1 бромцианом (CNBr) образовались кислый тетрапептид P3 и дипептид P4.
В результате обработки P2 1-фтор-2,4-динитробензолом с последующим полным гидролизом образовался N-2,4-динитрофенил-Glu
Пептиды P1, P2 и P3 содержат серин из активного центра.
Из приведенной выше информации выведите аминокислотную последовательность P1, P2, P3 и P4.
7.9 Рассчитайте молекулярную массу P3 в массовых единицах (Da), используя информацию из таблицы аминокислот, приведенной выше.
7.10. Уникальная микросреда в активном центре ![]() -лактамазы обеспечивает необычно высокую
нуклефильную реакционноспособность ОН-группы
каталитического серина. Константа скорости
первого порядка для реакции, катализируемой
-лактамазы обеспечивает необычно высокую
нуклефильную реакционноспособность ОН-группы
каталитического серина. Константа скорости
первого порядка для реакции, катализируемой ![]() -лактамазой, составляет 350 с–1. >При
гидролизе пенициллина в растворе ОН-группой
свободного серина (при концентрации 1 M),
константа скорости реакции псевдопервого
порядка составляет 0.5 с–1.
-лактамазой, составляет 350 с–1. >При
гидролизе пенициллина в растворе ОН-группой
свободного серина (при концентрации 1 M),
константа скорости реакции псевдопервого
порядка составляет 0.5 с–1.
Рассчитайте эффективную концентрацию нуклеофила серин-ОН в активном центре фермента.
7.11.Вещества, конкурирующие с пенициллином за
связывание с активным центром ![]() -лактамазы, могут
ингибировать фермент. Значения констант
диссоциации (KD) комплекса
ингибитор-лактамаза для трех различных
ингибиторов приведены ниже :
-лактамазы, могут
ингибировать фермент. Значения констант
диссоциации (KD) комплекса
ингибитор-лактамаза для трех различных
ингибиторов приведены ниже :
Ингибитор |
Константа диссоциации (KD) |
A |
2.0 |
B |
1.0 |
C |
5.0 |
Укажите, какой из этих ингибиторов наиболее эффективен для защиты пенициллина от действия -лактамазы.
Был разработан некоторый ингибитор ![]() -лактамазы. После связывания этого ингибитора с
активным центром фермента в результате
нуклеофильной атаки ОН-группой серина
раскрывается
-лактамазы. После связывания этого ингибитора с
активным центром фермента в результате
нуклеофильной атаки ОН-группой серина
раскрывается ![]() -лактамная часть ингибитора,
а также элиминируется Br– . В результате
этого образуется реакционноспособный
электрофил, который связывается с остатком Х
активного центра, инактивируя фермент
-лактамная часть ингибитора,
а также элиминируется Br– . В результате
этого образуется реакционноспособный
электрофил, который связывается с остатком Х
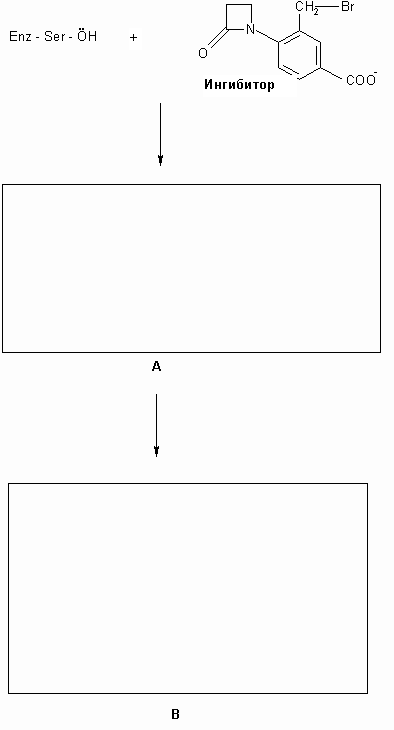
активного центра, инактивируя фермент
7.12. Приведите структуру электрофила (A) и конечного продукта (B), образующегося при инактивации фермента изображенным ниже ингибитором.