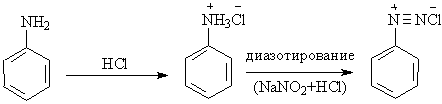
Задача 25. Определение содержания аспирина
в образце
Задача 26. Синтез 1-фенилазо-2-нафтола (C16H12ON2)
Задача 27. Определение содержания кальция в
растворе
Задача 28. Определение содержания метилкетона
обратным титрованием
Задача 29. Определение содержания фенола в
образце
Задача 30. Определение количества Fe (III) в образце
Задача 25. Определение содержания аспирина в образце
Ацетилсалициловая кислота (CH3COO- C6H4- COOH) гидролизуется при кипячении с водным раствором NaOH. Данная реакция и служит для определения аспирина.
Реактивы и растворы
Приготовление 0.1 М раствора HCl
В мерную колбу налейте 9 мл концентрированного раствора HCl, доведите объем раствора до 1000 мл, используя свежеприготовленную дистиллированную воду.
Приготовление 1 М раствора NaOH
В маленьком стаканчике быстро взвесьте примерно 10.5 г NaOH. Растворите его в минимальном количестве дистиллированной воды. Перенесите раствор в 250 мл колбу и разбавьте его дистиллированной водой.
Методика
Стандартизация HCl
Взвесьте точно 0.15 г буры и количественно перенесите её в чистую 250 мл коническую колбу; добавьте в неё 50 мл дистиллированной воды. Оттитруйте полученный раствор соляной кислотой, используя метиловый красный в качестве индикатора (переход окраски жёлтый -- красный).
| Вычислите концентрацию HCl в растворе. |
Холостое титрование
Разбавьте 25 мл 1 М раствора NaOH в 250 мл мерной колбе, используя свежеприготовленную дистиллированную воду. Отберите 25 мл разбавленного раствора NaOH при помощи пипетки и оттитруйте его раствором HCl, используя фенольный красный в качестве индикатора (переход окраски красный – жёлтый)
Титрование аликвоты образца
Точно взвесьте примерно 1.5 г растёртой
таблетки аспирина и количественно перенесите
образец в 250 мл стакан. С помощью пипетки добавьте
25 мл 1 М раствора NaOH и перемешайте содержимое.
Осторожно нагревайте смесь на водяной бане в
течение 15 минут, затем охладите раствор и
перенесите его в 250 мл мерную колбу. Доведите
раствор до метки дистиллированной водой и
перемешайте его. Оттитруйте 25 мл приготовленного
таким образом раствора стандартизованным
раствором HCl, используя феноловый красный в
качестве индикатора (переход цвета красный –
жёлтый).
| 1.Запишите уравнение реакции гидролиза
ацетилсалициловой кислоты. 2.Рассчитайте содержание аспирина в образце. |
Задача 26. Синтез 1-фенилазо-2-нафтола (C16H12ON2)
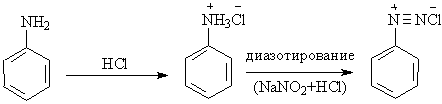
Реакции
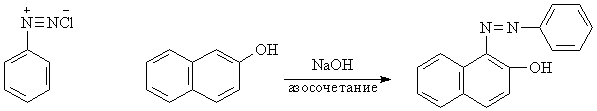
Реактивы и растворы
Приготовление соли диазония
Поместите 1 мл анилина в чистый 50 мл стаканчик. Добавьте примерно 5 мл дистиллированной воды. Поставьте стакан в ледяную баню. Медленно добавьте 2.5 мл концентрированной HCl. Перемешайте смесь стеклянной палочкой до получения прозрачного раствора. Охладите раствор в ледяной бане.
Точно отвесьте 0.5 г нитрита натрия (NaNO2) и
количественно перенесите его в 15 (или 25) мл
пробирку. Добавьте в пробирку 5 мл
дистиллированной воды для растворения нитрита
натрия. Охладите полученный раствор в ледяной
бане.
Дайте охладиться растворам до 0оС. По
каплям добавьте раствор нитрита натрия к
раствору анилина при постоянном перемешивании,
следя за тем, чтобы температура реакционной
смеси не поднималась выше 10оС.
Избыток азотистой кислоты в реакционной смеси
определяется при помощи иодкрахмальной бумаги.
Для разложения избытка азотистой кислоты
добавьте небольшое количество твёрдой мочевины,
после чего отфильтруйте раствор. Фильтрат
содержит соль диазония.
Реакция азосочетания
Взвесьте 0.75 г порошка ![]() -нафтола
в 50 мл стаканчике. Добавьте 5 мл 10% раствора NaOH и 5
мл дистиллированной воды. Стеклянной палочкой
хорошо перемешайте содержимое до получения
прозрачного раствора, который также охладите в
ледяной бане до 0оС.
-нафтола
в 50 мл стаканчике. Добавьте 5 мл 10% раствора NaOH и 5
мл дистиллированной воды. Стеклянной палочкой
хорошо перемешайте содержимое до получения
прозрачного раствора, который также охладите в
ледяной бане до 0оС.
При постоянном перемешивании добавьте по каплям
охлаждённый фильтрат, содержащий соль
диазония, к охлаждённому в ледяной бане раствор ![]() -нафтола. При этом начнёт
выпадать осадок красно-оранжевого цвета. После
прибавления всего раствора отфильтруйте осадок
на воронке Бюхнера. Промойте осадок холодной
водой. Высушите полученный продукт и рассчитайте
выход реакции.
-нафтола. При этом начнёт
выпадать осадок красно-оранжевого цвета. После
прибавления всего раствора отфильтруйте осадок
на воронке Бюхнера. Промойте осадок холодной
водой. Высушите полученный продукт и рассчитайте
выход реакции.
Определение температуры плавления
Перекристаллизуйте небольшое количество
синтезированного органического красителя из
этанола. Осторожно нагрейте раствор на
водяной бане до растворения красителя.
Отфильтруйте горячий раствор. Охладите фильтрат
и отфильтруйте перекристаллизованный продукт на
воронке Бюхнера.
1.Запишите массу сырого продукта реакции |
Задача 27. Определение содержания кальция в растворе
Реакция Ca2+ + H2Y2- ![]() CaY2- + 2H+
CaY2- + 2H+
Реактивы и растворы
Приготовление 0.01 М ЭДТА
Отвесьте 1.861 г Na2ЭДТА (чда) и количественно перенесите навеску в 500 мл мерную колбу. Добавьте дистиллированной воды до полного растворения соли и дистиллированной водой доведите раствор до метки.
Методика
Разбавьте дистиллированной водой выданный вам раствор до 100 мл в 100 мл мерной колбе. Отберите пипеткой 25 мл разбавленного раствора и перенесите аликвоту в чистую коническую колбу. Добавьте 25 мл дистиллированной воды и доведите рН раствора до 12, используя свежеприготовленный раствор KOH. Проверьте уровень рН индикаторной бумагой. Добавьте несколько крупинок индикатора и проведите титрование раствором Na2ЭДТА (изменение окраски винно-красный – синий).
| Рассчитайте количество кальция, ммоль в 100 мл разбавленного раствора. |
Задача 28. Определение содержания метилкетона обратным титрованием
Содержание метилкетонов (например, ацетона) можно определять иодированием избытком стандартного раствора иода в щелочной среде. Затем непрореагировавший иод оттитровывается стандартизованным раствором тиосульфата натрия.
Реактивы и растворы
Приготовление 0.1 М Na2S2O3
Взвесьте 25 г Na2S2O3 (чда) и количественно перенесите его в 1 л мерную колбу. Приготовьте раствор, используя свежеприготовленную дистиллированную воду. При приготовлении раствора добавьте в него три капли хлороформа. Старайтесь не подвергать раствор воздействию света.
Приготовление 0.1 н раствора I2
Растворите 20 г иодида калия, в котором отсутствует иод, в 30-40 мл дистиллированной воды в 1 л мерной колбе. Отвесьте 12.7 г иода и количественно перенесите его в приготовленный раствор иодида калия. Перемешайте содержимое колбы, встряхивая её до полного растворения иода, после чего доведите раствор до метки дистиллированной водой.
Методика
Стандартизация раствора Na2S2O3
Точно взвесьте 0.14-0.15 г сухого иодата калия. Растворите его в 25 мл свежеприготовленной дистиллированной воды и добавьте 2 г иодида калия, не содержащего примесей иодата. Добавьте 5 мл 1 н раствора серной кислоты. При постоянном перемешивании оттитруйте выделившийся иод раствором тиосульфата. Когда цвет раствора станет бледно-жёлтым, добавьте 200 мл дистиллированной воды и 2 мл раствора крахмала. Продолжайте титрование, пока синий раствор не станет бесцветным.
Определение кетона
Точно взвесьте 0.2 г выданного образца ацетона в чистом 50 мл стаканчике и добавьте минимальное количество дистиллированной воды. Перенесите раствор ацетона в 250 мл мерную колбу. Добавьте в колбу дистиллированной воды для растворения ацетона, после чего доведите раствор до метки дистиллированной водой. Отберите пипеткой 10 мл раствора ацетона в чистую коническую колбу. Добавьте 10 мл 10% раствора гидроксида натрия и закройте колбу пробкой. Встряхивайте колбу в течение 10 мин, после чего добавьте из бюретки 35 мл 0.1 н раствора иода. Перемешайте содержимое колбы, желательно с помощью магнитной мешалки, в течение 5 минут. После этого дайте колбе постоять 15 минут.
Появятся жёлтые кристаллы иодоформа. Подкислите раствор серной кислотой, контролируя уровень рН индикаторной бумагой.
Оттитруйте раствор стандартизованным раствором тиосудьфата, используя крахмал в качестве индикатора.
| Запишите уравнения химических реакций
иодирования ацетона. Рассчитайте количество ацетона в выданном Вам образце. |
Задача 29. Определение содержания фенола в образце
Реакции
KBrO3 + 5KBr + 6HCl ![]() 6KCl + 3H2O
+ 3Br2
6KCl + 3H2O
+ 3Br2
C6H5OH + 3Br2 ![]() C6H2OHBr3 + 3HBr
C6H2OHBr3 + 3HBr
3Br2 + 6KI ![]() 6KBr + 3I2
6KBr + 3I2
2Na2S2O3 + I2 ![]() 2NaI + Na2S4O6
2NaI + Na2S4O6
Реактивы и растворы
Приготовление 0.1 М Na2S2O3
Взвесьте 25 г Na2S2O3 (чда) в маленьком стаканчике. Количественно перенесите его в 1 л мерную колбу. Приготовьте раствор, используя свежеприготовленную дистиллированную воду. При приготовлении раствора добавьте в него три капли хлороформа. Старайтесь не подвергать раствор воздействию света.
Стандартизация раствора Na2S2O3
Точно взвесьте 0.14-0.15 г сухого иодата калия. Растворите его в 25 мл свежеприготовленной дистиллированной воды и добавьте 2 г иодида калия, не содержащего примесей иодата. Добавьте 5 мл 1 н раствора серной кислоты. При постоянном перемешивании оттитруйте выделившийся иод раствором тиосульфата. Когда цвет раствора станет бледно-жёлтым, добавьте 200 мл дистиллированной воды и 2 мл раствора крахмала. Продолжайте титрование, пока синий раствор не станет бесцветным.
Методика
Растворите выданный вам образец фенола в дистиллированной воде и доведите объём раствора до 250 мл. Отберите 25 мл раствора фенола в 250 мл колбу с пробкой. Добавьте 25 мл стандартизованного раствора бромата калия и 0.5 г бромида калия. Добавьте 5 мл 3 М серной кислоты. Немедленно закройте колбу. Перемешайте реагенты, после чего дайте реакционной смеси постоять в течение 15 минут. Старайтесь не подвергать раствор воздействию света. Затем быстро добавьте 2.5 г иодида калия. Немедленно закройте колбу. Перемешайте содержимое колбы до растворения соли.
Выделившийся иод оттитруйте из бюретки стандартизованным 0.1 М раствором Na2S2O3, используя крахмал в качестве индикатора.
| Рассчитайте количество фенола в 250 мл раствора. |
Задача 30. Определение количества Fe (III) в образце
Fe(III) в исследуемом растворе сначала восстанавливается до Fe (II) в среде HCl хлоридом олова. Избыток хлорида олова окисляется добавлением хлорида ртути (II). Затем Fe (II) титруется стандартизованным раствором дихромата калия.
Реактивы и растворы
Внимание: Для приготовления исследуемого раствора используется NH4Fe(SO4)2. 12H2O
Приготовление 0.1 н раствора K2Cr2O7
Точно отвесьте 1.225 г чистого K2Cr2O7 и перенесите его в 250 мл мерную колбу. Приготовьте раствор, используя дистиллированную воду.
Методика
Доведите объём выданного вам раствора Fe (III) до метки в 100 мл мерной колбе. Отберите 10 мл разбавленного раствора в чистую коническую колбу. Добавьте 2 мл концентрированной соляной кислоты, нагрейте раствор до кипения. К горячему раствору по каплям добавьте раствор SnCl2 до обесцвечивания реакционной смеси. Добавьте ещё 2-3 капли SnCl2.
Охладите раствор по струёй водопроводной воды. Добавьте 2-3 мл раствора HgCl2. Наблюдается выпадение белого осадка. Если выпадает серый осадок, вылейте раствор и повторите всё заново.
Добавьте 2-3 мл смеси серной и фосфорной кислот и 1 каплю дифениламина; оттитруйте раствор раствором K2Cr2O7 (изменение цвета: бесцветный – устойчивый синий или фиолетовый).
| Запишите уравнения
химических реакций. Рассчитайте количество Fe (III) и NH4Fe(SO4)2? 12H2O в 100 мл исследуемого раствора. |