Интернет-олимпиада по химии
Химическая термодинамика
Условие,
вопросы и ответы
В 1990 году Кратчмер и его соавторы (W.Kratschmer et al,
Nature,1990) сообщили, что им удалось получить несколько миллиграммов новой
аллотропной формы углерода – фуллерена.
Важнейшей стадией синтеза Кратчмера-Хоффмана было извлечение фуллеренов из
углеродной сажи в бензольный раствор. Оказалось, что в отличие от графита,
алмаза и аморфного углерода, фуллерены растворимы в ароматических растворителях.
Эта растворимость служит теперь основой методов очистки и разделения фуллеренов
(т.е. отделения фуллерена С60 от фуллеренов С70, С84
и т.д.).
Бакминстерфуллерен С60 обладает интересным
свойством. Его растворимость в некоторых ароматических растворителях – C6H6, C6H5CH3,
C6H5Br – при
увеличении температуры Т (давление Р = const) проходит через
острые максимумы (Тmax). С другой стороны, растворимость С60
в р-C6H4(CH3)2 с температурой
плавно падает и не имеет экстремумов. Концентрация С60 в обсуждаемых
насыщенных растворах составляет 10–4
– 10–5
моль/л. Молекулярная масса С60, определенная из осмотического
давления толуольного раствора, равна 720 ±
30.
Вопросы.
I.
Как изменяется химический потенциал вещества при его переходе из чистого
твердого вещества: а) в насыщенный раствор; б) в ненасыщенный раствор?
Запишите
термодинамическое уравнение, описывающее температурную зависимость
растворимости химического вещества с образованием идеального и неидеального
растворов. Могут ли эти уравнения объяснить падение растворимости с
температурой? Могут ли они объяснить появление максимумов растворимости?
Объясните.
Условия
фазового равновесия требуют равенства химических потенциалов растворяемого
вещества А в твердой фазе и в насыщенном растворе. В ненасыщенном растворе
химический потенциал А ниже, чем в твердой фазе. Предполагается, что давление и
температура твердой фазы и раствора – одинаковые.
(Участники Олимпиады прислали в ответ 62 разумные реплики,
«прислано 62 р.р.»)
В общем случае (реальные растворы)
зависимость растворимости х от температуры Т описывается уравнением
(∂x/∂T)P,нас = ΔHраст./ RT2/ (∂lna/∂x)T,P (1)
Здесь ΔHраст
– энтальпия растворения. Если насыщенный
раствор является разбавленным и подчиняется закону Генри, получается очень
полезное для нас уравнение
(∂lnх/∂T)P,нас = ΔHраст./ RT2 (2)
Для случая идеального раствора (1)
превращается в (3), т.н. уравнение Шредера :
(∂lnх/∂T)P,нас = ΔHпл./ RT2 (3)
Здесь ΔHпл - энтальпия плавления. Энтальпия плавления,
конечно, положительна при температуре плавления. Однако, если учесть ее зависимость
от температуры,
ΔHпл(Т) = ΔHпл(Tпл) + ∫ (сp(ж) – cp(тв))
dT (4)
то даже в идеальном случае при
температурах много ниже температуры плавления можно и изменить знак в числителе
правой части (3). Тогда растворимость с температурой будет падать.
Отрицательные энтальпии растворения
– вещь вполне обычная. Поэтому уравнение (1) вполне допускает уменьшение
растворимости при увеличении температуры. Производная (∂lna/∂x)T всегда больше нуля,
иначе раствор расслаивается.
Допускается ли возможность экстремумов?
В принципе, да. В уравнениях (1) и (2)
ΔHраст может изменить знак при изменении температуры. В
уравнении (3) знак ΔHпл может поменяться за счет интеграла в правой части.
Температура, которой будет соответствовать ΔHраст =0
(или ΔHпл = 0) – есть экстремум растворимости. Едва ли,
однако, экстремумы будут острыми. И едва ли такие фокусы возможны в разбавленных
растворах.
Обратим внимание еще на одно
обстоятельство. Очевидно, что
ΔHраст = (Н(А, раствор) – Н(А,
твердая фаза) (4)
Н(А, раствор), Н(А, твердая фаза) – парциальные
энтальпии растворяемого вещества А в растворе и твердой фазе. Н(А,
твердая фаза) может измениться скачком. Например, за счет фазового перехода,
превращения одной кристаллической модификации А в другую. Это даст резкий
скачок ΔHраст (и ΔHпл), возможно,
смену знака, и, следовательно, экстремум растворимости.
(Прислано 32 р.р.)
II.
Было выдвинуто несколько гипотез, объясняющих необычную температурную зависимость
растворимости С60. Проанализируйте каждую из них и укажите,
насколько она соответствует перечисленным в условии экспериментальным фактам:
а) Фуллерен С60
растворяется за счет образования комплексов с растворителем (явление напоминает
химический транспорт); равновесная концентрация комплексов с температурой
падает;
Имеются в виду, конечно, комплексы
в жидком растворе.
Зададимся таким вопросом: « Что
нового вносит эта гипотеза? Разве уравнение (1), а для разбавленных растворов
фуллеренов уравнение (2), не описывают такую ситуацию ? »
Конечно, описывают ! В том-то и
сила термодинамических уравнений, что они справедливы при любом молекулярном
составе растворов.
Да, можно предположить, что
комплексы С60 с растворителями в растворе существуют. Тогда ΔHраст
можно связать с энтальпиями диссоциации этих комплексов. Вы смоделируете ΔHраст,
вот, и все. А дальше – разговоры о зависимости этой энтальпии от температуры
(см.выше, см пункт IIд).
(Прислано 0 р.р.)
б) Фуллерен С60 образует
кинетически устойчивые нанокластеры в растворе, которые с повышением
температуры выше Тmax начинают разрушаться, мономеры С60
нерастворимы из-за очень высокой энергии активации этого процесса;
Этот вариант не связан с
термодинамическими уравнениями и предполагает отсутствие равновесия. Уравнения
(1-4) не работают. Чистая кинетика! Первое, что нужно сделать, - доказать
существование кластеров. Данные по осмотическому давлению подсказывают, что во
всяком случае в толуольном растворе кластеров нет. Молекулярный вес равен весу
мономера.
Хотя, может быть, и уравнение
Вант-Гоффа для осмотического давления не работает?
(Прислано 34 р.р.)
в)
Фуллерен С60 образует соединения с растворителями в твердой фазе.
Они разлагаются точно при температурах Тmax.
Впоследствии мы узнаем, что это
верный ответ. Пока же вспомним, что твердые «соединения с растворителями» называют
кристаллосольватами. Их разложение на твердое вещество А и жидкий растворитель
называется инконгруентным плавлением. По своим свойствам инконгруентное
плавление – фазовый переход первого рода. Скачком изменится Н(А, твердая
фаза) и, следовательно, энтальпия растворения фуллерена в уравнении (1). Если
ΔHраст сменит знак с плюса на минус, это и приведет к
появлению максимума. Разные растворители могут образовывать с С60
сольваты разного состава и разной устойчивости. Следовательно, максимумы
растворимости будут наблюдаться при разных температурах. А в некоторых растворителях
(допустим, в пара-ксилоле) сольвата может не быть совсем!
(Прислано 21
р.р.)
г)
В твердом фуллерене С60 происходит фазовый переход первого рода при
Т = Тmax.
Эта гипотеза похожа на (в). Разница
между (в) и (г) в том, что фазовый переход в чистом твердом фуллерене обязан
дать максимум (или во всяком случае особую точку) во всех растворителях и
при одной и той же температуре. Почему же нет максимума в пара-ксилоле?
(Прислано 27 р.р.)
В условии задачи сказано осторожно,
что «растворимость в ароматических растворителях… при увеличении температуры Т
(давление Р = const) проходит через острые максимумы (Тmax)».
«Тmax» в разных растворителях – одна и та же?
Если «да», то
не проходит гипотеза (в).
Если температуры разные, то не
проходит (г).
(Прислано 0 р.р.)
д)
Энтальпия растворения С60 меняет знак при температурах, близких к Тmax.
Этот вариант разобран выше (см. I). Он описывается уравнениями (1) и (2). ΔHраст.
с температурой может меняться и проходить через ноль.
Да, это возможно. Но максимум будет
плавным.
Практическое соображение – в
разбавленных растворах ΔHраст. от температуры зависит
слабо.
(Прислано 37 р.р.)
III.
В вашем распоряжении появились новые экспериментальные данные:
а) УФ-спектры растворов С60
в C6H6, C6H5CH3 и р-C6H4(CH3)2
при нескольких температурах;
б) ЭПР спектры растворов С60
в C6H5Br и р-C6H4(CH3)2;
в) Данные по криоскопии растворов С60
в C6H6, C6H5CH3;
г) ПМР спектры раствора С60
в C6H5Br и системы {С60(тв) - насыщенный
раствор С60 в C6H5Br} при температурах выше и
ниже Тmax в этой системе;
д) Рентгенограммы твердой фазы,
находящейся в равновесии с насыщенным раствором С60 в C6H6
при температурах выше и ниже Тmax в этой системе. .
Могут ли эти новые результаты помочь подтвердить или
опровергнуть какую-либо из гипотез (1-5)
из пункта II? Дайте свои комментарии по поводу
возможностей каждого из методов (1-5) в пункте III.
a) УФ-спектры
должны показать наличие или отсутствие в растворах комплексов фуллерена с
растворителями. На образование комплексов укажут новые пики или «горбы».
Нанокластеры будут скорее рассеивать, чем поглощать в УФ. Получатся гладкие
кривые без пиков.
Но в любом
случае - если спектр похож на УФ фуллерена в газовой фазе, не меняется с температурой
и спектр в пара-ксилоле не отличается от остальных - вероятнее всего о
гипотезах а) и б) нужно забыть!
(Прислано 19 р.р.)
б) ЭПР спектры
не помогут. Парамагнитных частиц в системе нет.
(Прислано 23 р.р.)
в) В принципе, криоскопия может
почувствовать образование кластеров. Однако, концентрация насыщенных растворов
слишком мала.
Один из участников отметил, что
измерения нужно будет проводить вблизи температуры плавления растворителя, т.е.
много ниже температуры максимума. Верно! Осмометрия для нас полезнее
криоскопии.
(Прислано 29 р.р.)
г) Ниже температуры максимума пик в
ПМР спектре – острый в центре, но с широкими боковыми «крыльями». Выше Тmax
остается только центральная острая часть. У бромбензола в твердой фазе
заморожено внутреннее вращение, поэтому пик сильно уширен.
Такой спектр доказывает, что ниже Тmax
бромбензол находится и в жидкой и в твердой фазе, а выше – только в
жидкой. Таким образом, можно убедительно подтвердить или опровергнуть гипотезу
(в).
Красивый и необычный эффект! Приятно,
что несколько участников Олимпиады четко ответили на этот вопрос.
(Прислано 3 р.р.)
д) Если рентгенограммы выше и ниже
температуры максимума различны, то очевидно максимум как-то связан с фазовым
превращением в твердой фазе. Это указывает на варианты в) и г).
((Прислано 40 р.р.)
IV.
В дальнейшем были сняты кривые нагревания систем {С60(тв) – насыщенный раствор С60 в C6H5CH3}
и {С60(тв) – насыщенный
раствор С60 в p-C6H4(CH3)2}
в дифференциальном сканирующем калориметре.При температуре максимума растворимости С60 в C6H5CH3
был обнаружен эндо-эффект (поглощение тепла). В системе с пара-ксилолом никаких
эффектов нет.
а) Какая из
первоначальных гипотез (а-д) пункта II становится теперь наиболее правдоподобной? Напишите
термодинамические уравнения, объясняющие появление максимумов растворимости по
температуре.
б)
Нарисуйте схематически диаграмму состояния (T - x) системы С60 – C6H5Br (T < 450 К), где при
температуре 350 К наблюдается максимум растворимости. Диаграмма должна
объяснять на качественном уровне причину появления максимума.
а) Ну, вот, теперь все ясно!
Эндо-эффект указывает на фазовое превращение в твердой фазе. Фазовый переход в
самом фуллерене ( гипотеза (г)) должен был бы наблюдаться и в случае
пара-ксилола. Значит, проходит вариант (в). Причина появления максимума –
инконгруентное плавление кристаллосольвата.
При температурах ниже максимума в
равновесии с раствором находится соединение фуллерена с растворителем
(кристаллосольват), выше - чистый фуллерен. Тепловой эффект наблюдавшийся в опыте
- теплота инконгруентного плавления. Теплоты растворения ниже и выше максимума
отличаются на теплоту разложения кристаллосольвата.
Процесс ниже температуры максимума:
С60*mS(тв) + nS ® С60(в растворе) + (n+m)S (5)
выше максимума
С60(тв) + nS ® С60(в
растворе) + nS (6)
Здесь S –
жидкий растворитель
Разница в энтальпиях двух процессов
растворения (5) и (6) – это энтальпия процесса разложения кристаллосольвата:
С60*mS(тв) ® С60(тв)
+ mS (7)
Справедливо соотношение
ΔH(6) + ΔH(7) = ΔH(5)
ΔH(7), энтальпия разложения сольвата, больше нуля (иначе,
почему он существует?). Тогда ΔH(6)
может быть отрицательной, а ΔH(5) –
положительной величиной!
ΔH(6) и ΔH(5) будут числителями в уравнении
(2).
(Прислано 7 р.р.)
Разумеется, не всякое инконгруентное
плавление даст максимум растворимости. Возможно ΔH(5) и ΔH(6) будут иметь одинаковый
знак (обе энтальпии – отрицательны или обе – положительны). Тогда на кривой
растворимости будет наблюдаться излом.
Излом – хорошо известный случай, он
описан в любом учебнике по химической термодинамике, максимум – случай
аномальный.
б) Это задание оказалось самым
трудным. Однако, победитель такую диаграмму построил. Вот она:
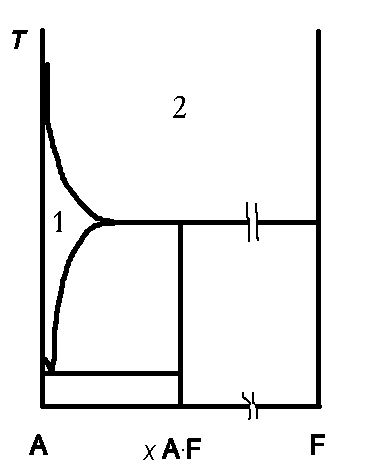
«Птичка» слева – это состав
насыщенного раствора при разных температурах. Сольват состава xA*F (A– растворитель, F– фуллерен) существует только до температуры
максимума!
Историческая справка
Дискуссия о природе максимумов растворимости фуллеренов
тянулась несколько лет.
В условии задачи достоверно, хотя и в несколько гротескной
форме, изложены выдвигавшиеся гипотезы и реальные экспериментальные результаты
- все, что было известно зимой 1995 года.
Через пару лет подтвердилась гипотеза II(в). Много
сторонников на первых порах было у модели II(г). А самой привлекательной,
современной казалась кластерная модель II(б). У этой бестолковой гипотезы до
сих пор высокий индекс цитирования! Интересно, что участники Олимпиады к
кластерной модели отнеслись равнодушно.
Максимум растворимости в точке инконгруентного плавления -
явление редкое и чисто термодинамическое. Изюминка в том, что свойства
конкретной системы в уравнениях прямо не проявляются. Фуллерены в ароматических
растворителях дают яркий, но не единственный пример. Уже около ста лет назад
было известно о максимуме растворимости в системе Na2SO4 – H2O. У него та же самая природа.
Забавная деталь:
один из участников Олимпиады читал об аномальном ходе растворимости сульфата натрия,
знал его причину, но, представьте, гипотезу II(в) для фуллеренов не поддержал!
Качество
присланных решений.
В целом - неплохо. Много выдумки, хороших идей. Широкий
кругозор. А вот точных, грамотных ответов - маловато. В уравнениях - ошибка на
ошибке. Элементарного уравнения (2) нет ни в одной работе, хотя для решения оно
- самое важное.
Оценка
решений.
Олимпиада - не контрольная работа. Поэтому - никаких
придирок. Очки щедро давались за любую разумную реплику (р.р.), хотя р.р. это
далеко не п.о., то есть не “правильный ответ”. Итак, очки давались щедро, но
справедливо. Одинаковые по качеству ответу старались оценить одинаково.
Коробов Михаил Валерьевич, профессор кафедры физической
химии Химического факультета МГУ
korobov@phys.chem.msu.ru
Литература.
1.
Ruoff
R.S., Malhotra R., Huestis D.L., Tse D. S., and Lorents D. C., «Anomalous
solubility behavior of C60» Nature,
1993, v.362, pp.1402-3.
2. В.А.Дуров, Е.П.Агеев,
Термодинамическая теория растворов неэлектролитов, М., Из-во Моск. ун-та, 1987.
Остальное
даст поиск в интернете.


