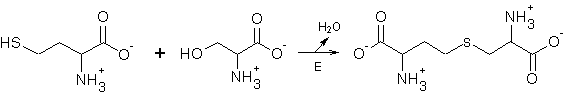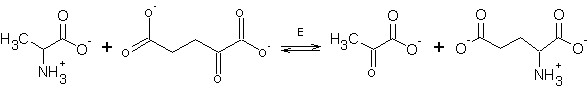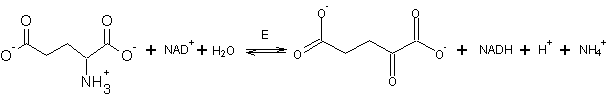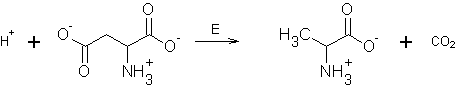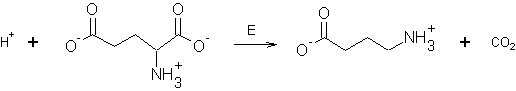Интернет-олимпиада по химии
Биохимия
Ряд важных метаболических
превращений аминокислот протекает с участием кофермента пиридоксальфосфата (I), который, конденсируясь с
аминокислотами, образует соединение (II)
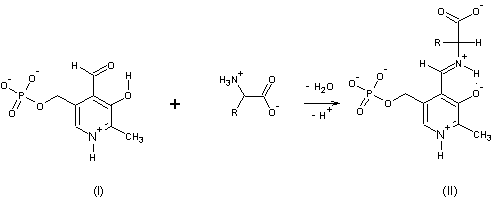
1а. К какому классу относится
соединение (II)?
Шиффовы основания или соединения с
азометиновой связью.
Этот вопрос не вызвал затруднений.
1б. К какому типу катализа относятся реакции с
участием пиридоксальфосфата?
Исходя из схемы, приведенной в
начале задаче, это ковалентный электрофильный катализ.
Большинство участников привело ответ «Ферментативный».
Данный ответ был оценен лишь частичным баллом, поскольку, с одной стороны, не
является полным, с другой стороны, пиридоксальфосфат способен выступать
катализатором и в отсутствии белковой части фермента, с третьей стороны, в
постановочной части задачи еще ничего не было сказано о ферментах.
В соединении (II) любая из групп, окружающих хиральный атом углерода
аминокислоты, может отщепиться с образованием аниона.
2. Что
способствует снижению электронной плотности хирального атома углерода
аминокислоты?
Наличие электроноакцепторных заместителей в a-положении
(пиридоксилиденовой группы, присоединенной через аминный азот и a-карбоксильной
группы) и индуктивные взаимодействия.
Большинство участников справилось с этим вопросом.
С геометрической точки зрения в соединении (II) будет разрываться та связь при Сa-атоме, которая перпендикулярна плоскости p-системы субстрат-коферментного имина.
3а. Объясните, что способствует разрыву именно этой
связи.
При перпендикулярном расположении
связи:
а) достигается максимально возможное
s-p-перекрывание разрываемой связи и p-системы имина кофермента, вследствие чего энергия
переходного состояния снижается до минимума
б) реализуется геометрия, наиболее близкая к
образующемуся в последствии плоскому хиноидному производному, вследствие чего
сводятся к минимуму молекулярные перемещения, необходимые для переходного
состояния.
Большинство участников привело лишь одну из двух причин.
3б. Как достигается необходимая геометрия субстрат-коферментного
имина в пиридоксальфосфат-содержащих ферментах, катализирующих различные
превращения одного и того же субстрата?
Наиболее общий ответ – за счет
связывания субстрата в активном центре фермента в результате невалентных
взаимодействий. Связывание субстрата в сорбционнос участке ферментов
стереоспецифично. Ферменты с различной специфичностью имеют геометрически
различающиеся сайты связывания. В результате этого для различных ферментов
перпендикулярными p-системе будут связи с
разными заместителями при Сa-атоме.
Этот вопрос у большинства участников не вызвал затруднений.
Тексты ответов были различными, но суть была «ухвачена» правильно.
Пиридоксальфосфат выступает в качестве кофермента в
различных реакциях, таких как:
1) Элиминирование и замещение
заместителей при Сa-атоме
1.1. рацемизация
аминокислот
1.2. трансаминирование
1.3. a-декарбоксилирование
1.4. a,b-расщепление b-гидроксиаминокислот
2) Элиминирование и замещение
заместителей при Сb-атоме
2.1
элиминирование Ha и
полярного заместителя при Сb-атоме
2.2
замещение полярного заместителя при Сb-атоме
2.3
b-декарбоксилирование
3) Элиминирование и замещение
заместителей при Сg-атоме
3.1. элиминирование Hb и полярного
заместителя при Сg-атоме
3.2. замещение полярного
заместителя при Сg-атоме.
4. Запишите реакцию
образования цистатионина из L-гомоцистеина и L-серина под действием пиридоксальфосфат-содержащего фермента
цистатионинсинтазы и укажите номер, соответствующий данной реакции в
приведенной выше классификации реакций с участием пиридоксальфосфата.
Номер по классификации 2.2.
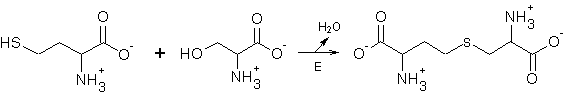
Многие участники сделали правильный выбор в пользу номера
2.2., а не 3.2., т.е. правильно определили замещаемый полярный радикал.
5а. Запишите реакцию
трансаминирования L‑аланина,
задействованную для обеспечения транспорта аммиака в организме.
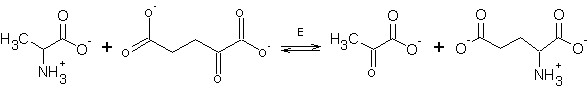
В организме для обеспечения транспорта аммиака
используется именно эта реакция, то есть главным было правильно выбрать второго
участника реакции - a-кетоглутарат
(пояснения см. в ответе на вопрос 5в).
5б. Приведите название
метаболического процесса транспорта аммиака, в котором задействована реакция
трансаминирования L‑аланина.
Глюкозо-аланиновый цикл.
Правильный ответ дали лишь два участника. Самый
распространенный ответ на данный вопрос – цикл мочевины (орнитиновый). Однако
это неправильно, поскольку в протекающем в печени орнитиновом цикле из аммиака
синтезирутся мочевина, далее выводящаяся из организма. К транспорту же аммиака
в организме данный цикл отношения не имеет.
5в. Объясните выбор второго участника
реакции трансаминирования и подкрепите свои рассуждения соответствующей
реакцией.
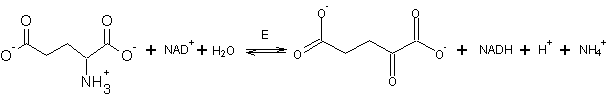
В результате реакции трансаминирования с 2-кетоглутаратом
образуется глутамат, а это единственная аминокислота, которая может с высокой
скоростью дезаминироваться по альтернативному пути – через дегидрогеназную
реакцию.
При расщеплении аминокислот важно не только «собрать»
аминогруппы со всех аминокислот и перенести в печень, но необходимо также
«передать» эти аминогруппы в орнитиновый цикл. Очевидно, что в рамках только
реакций трансаминирования этого сделать невозможно, и необходима альтернативная
эффективно протекающая реакция.
6. Запишите реакцию b-декарбоксилирования
одной из канонических a-аминокислот и укажите номер, соответствующий
данной реакции в приведенной выше классификации реакций с участием
пиридоксальфосфата.
Номер по классификации 2.3.
Единственная из канонических аминокислот, которая может подвергнуться b-декарбоксилированию – это аспартат.
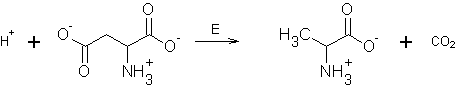
Здесь единственная «загвоздка» - правильно выбрать
аминокислоту - аспартат.
Одним из
пиридокальфосфат-содержащих ферментов является глутаматдекарбоксилаза.
7. Запишите реакцию,
катализируемую данным ферментом.
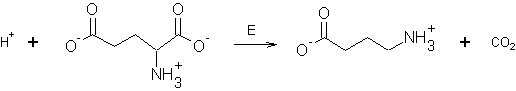
В принципе существует два
варианта декарбоксилирования глутамата – альфа- и гамма-. В действительности
протекает a-декарбоксилирование.
Но даже не зная этого, вполне можно было дать правильный ответ. В пользу a-декарбоксилирования говорит следующее:
А) a-декарбоксилирование представлено в классификации, а g-декарбоксилирования там нет;
Б) согласно вопросу 11, побочной реакцией при катализе
данным ферментом является трансаминирование;
В) в таблице в вопросе 8
приведен ряд соединений, общим свойством которых является наличие a-карбоксильной группы (если бы реакцией, катализируемой
глутаматдекарбоксилазой, было g-декарбоксилирование,
то для выявления требований к субстрату было бы логично сравнивать соединения с
g-карбоксильной группой).
Для прояснения механизма катализа
глутаматдекарбоксилазой и выявления особенностей строения ее активного центра
были определены каталитические константы ферментативного превращения
специфического субстрата и ряда его аналогов (данные в таблице).
|
Аминокислота
|
kкат, с-1
|
Км (каж.),
мМ
|
|
Глутаминовая
|
142,60
|
0,6
|
|
4-Фторглутаминовая
|
47,40
|
8,9
|
|
4-метиленглутаминовая
|
30,70
|
4,1
|
|
Трео-3-метилглутаминовая
|
0,30
|
-
|
|
Гомоцистеиновая
|
0,23
|
30,0
|
|
a-Аминоадипиновая
|
0,18
|
-
|
|
2-Метилглутаминовая
|
0,13
|
6,6
|
|
Аспарагиновая
|
0,06
|
11,5
|
|
4-Фосфоно-2-аминомасляная
|
-
|
-
|
8. Используя данные таблицы,
сделайте выводы о взаимосвязи структуры субстрата и эффективности
каталитического процесса (проанализируйте, какие участки субстрата критичны, а
какие нет для эффективного протекания ферментативной реакции).
В структуре субстрата важно:
для высокой каталитической
константы: наличие второй карбоксильной группы, длина субстрата, отсутствие
заместителей в положении 2.
для каталитической константы не так
критичны заместители в положениях 3 и 4.
О связывании однозначные выводы
сделать тяжелее: любое изменение увеличивает значение константы Михаэлиса, но
примерно одинаково (на порядок), в то время как каталитическая константа
существенно более чувствительна к природе и положению заместителей.
Участникам, отвечавшим на данный
вопрос, удалось обнаружить многие из приведенных выше закономерностей.
В
отсутствие субстрата, пиридоксальфосфат связан внутренней альдиминной связью с
остатком лизина самого фермента. При связывании субстрата происходит замещение
остатка лизина, причем реакция проходит через стадию образования диамина.
9.
Приведите схему реакций, протекающих при замещении остатка лизина субстратом.
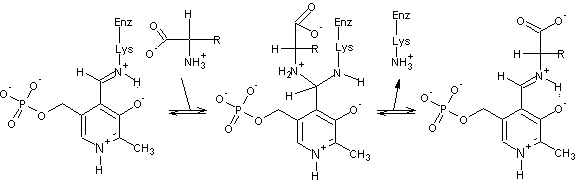
В промежуточном соединении также
приемлема структура, в которой атом азота, принадлежащий аминокислоте,
незаряжен, а атом азота e-аминогруппы
лизина заряжен (на самом деле, детектируются обе структуры). Большинство
участников справилось с данным вопросом.
Установлено, что ключевую роль в
катализе глутаматдекарбоксилазой играют два остатка аргинина.
10. Выскажите предположение, с какими группами
взаимодействуют данные остатки аргинина.
Из анализа структуры кофермента и субстрата, а также
механизма реакции можно заключить, что есть только два потенциальных сайта для
взаимодействия с заряженными положительно остатками аргинина: это фосфатная
группа кофермента и дистальная карбоксильная группа субстрата.
Большинство участников правильно
назвало дистальную карбоксильную группу, однако на взаимодействие с фосфатной
группой кофермента указал только один участник. В качестве второго «партнера»
остатка аргинина гораздо чаще предлагался вариант a-карбоксильной группы, но это неверно, поскольку a-карбоксильная группа является одной из потенциальных
уходящих групп и, в связи с этим, должна присутствовать в свободном виде.
Ниже приведена последовательность
реакций, протекающих при декарбоксилировании L-глутамата, а также - при побочной реакции трансаминирования
этой аминокислоты (боковой радикал глутамата обозначен как R). Под исходным веществом и буквами, обозначающими
промежуточные продукты, приведены соответствующие им значения максимумов
поглощения.
11. Расшифруйте
последовательность (приведите формулы соединений А-G, продукта1 и продукта2).
Учтите, что Enz
и Enz’
обозначают, что формы фермента в части кофактора по завершении реакций
декарбоксилирования и трансаминирования неидентичны.
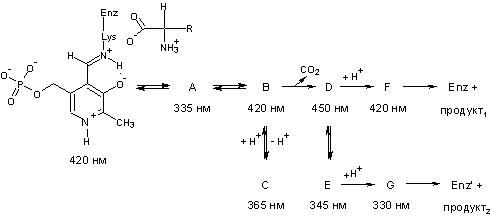
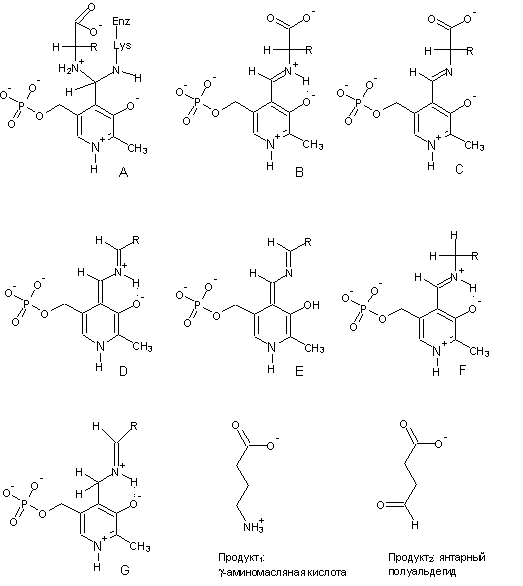
11. К решению данного вопроса можно
подходить различными путями. Ниже предложен один из путей. Основой нашей
стратегии будут химические превращения, а длины волн максимума поглощения мы
будем использовать во вспомогательных целях.
Декарбоксилирование,
как было сказано в начале текста задачи, происходит непосредственно из
соединения (II). Соответственно, установлена структура соединения В, а также
продукта его депротонирования – соединения С. Соединение А уже приводилось в
ответе на вопрос 9, при этом в пользу тетраэдрического состояния Сa-атома и отсутствия сопряжения в соединении А говорит низкое
значение его lмакс. Теперь зайдем с другой стороны и разберемся с продуктами. В
случае декарбоксилирования (см. ответ на вопрос 7) – это g-аминомасляная кислота, которую для удобства обозначим как Х.
Тогда Y – продукт побочной реакции трансаминирования – янтарный
полуальдегид. Вещество Х образуется в результате реакции гидролиза, при этом
другой продукт, Е, – это регенерированный фермент с кофактором –
пиридоксальфосфатом. Исходя из этого, находим структуру соединения F. Теперь мы можем определить соединение D, депротонированный предшественник соединения F. Сравнивая структуры соединений B и D, приходим к выводу, что D
получается непосредственно из В в результате декарбоксилирования. Значит Х =
продукт1, а Y = продукт2. Наряду с
продуктом2, образуется фермент с измененной формой кофактора –
пиридоксаминфосфатом. Учитывая, что эти продукты также образуются в результате
гидролиза, определяем структуру соединения G.
Наконец, находим структуру соединения Е, учитывая, что оно, с одной стороны,
находится в равновесии с соединением D, а, с другой стороны,
является депротонированным предшественником соединения G. В
пользу такого вывода свидетельствует большое различие в значениях длин волн
максимумов поглощения соединений F и G (в соединении G сопряжение гораздо
меньше, чем в соединении F). Отметим также, что в соединениях D и Е протонами атакуются положения с наибольшим отрицательным
зарядом: в соединении D – Сa-атом аминокислоты, а в соединении Е – С-4’-атом кофактора.
Это, пожалуй, самая трудоемкая
часть задачи, хотя некоторым участникам удалось дать полный или практически
полный ответ на вопрос 11.
Все вопросы, оставшиеся
непроясненными, рад буду обсудить лично. Пишите:
gladilin@direct.ru
С уважением,
Александр Кириллович Гладилин
профессор кафедры химической
энзимологии
Химического факультета МГУ им. М.В.
Ломоносова
Литература
1. Ленинджер А. Основы биохимии. В 3-х т. тт. 1, 2. М.: Мир,
1985.
2. Элиот В., Элиот Д. Биохимия и молекулярная биология. М.:
НИИ Биомед. химии РАМН, 1999.
3. Фершт
Э. Структура и механизм действия ферментов. М.: Мир, 1980.
4.
Сухарева Б.С., Дарий Е.Л., Христофоров Р.Р. Глутаматдекарбоксилаза: структура и
каталитические свойства // Успехи биологической химии, т. 41, с. 131-162, 2002.