Интернет-олимпиада по химии
Аналитическая химия
Для разделения изотопно
замещенных молекул бензойной кислоты C6H5C16O16OH (HA16) и C6H5C18O18OH (HA18) использованы методы высокоэффективной жидкостной
хроматографии (ВЭЖХ) и капиллярного электрофореза.
Условия хроматографического
разделения: неподвижная фаза – силикагель-C18,
подвижная фаза – 20% метанол, 0,05 М ацетатный буфер, рН 4,83, 300С.
Условия электрофоретического
разделения: напряжение 40 кВ, общая длина капилляра L=750 мм, длина капилляра до детектора l=500 мм, 0,05
М ацетатный буфер, рН 4,00.
- Какая разновидность ВЭЖХ использована в данном
процессе?
Обращенно-фазовая.
Этот наиболее формальный ответ (с точки зрения сравнительной
полярности фаз) в данном случае является вместе с тем и наиболее точным и
однозначным. Ответы с точки зрения механизма разделения (адсорбционная,
распределительная, ион-парная) неточны, поскольку в такого рода системах
механизм обычно смешанный. Ответ с точки зрения техники работы («колоночная»)
лишен содержания, поскольку ВЭЖХ является колоночной по умолчанию.
- Напишите выражение зависимости коэффициента
емкости k’ слабой одноосновной кислоты HA от концентрации H+ в
подвижной фазе. Коэффициенты емкости для недиссоциированной и анионной
форм кислоты равны k’HA и k’A,
соответственно. Константа кислотной диссоциации HA равна Ka.
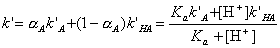 (здесь
(здесь 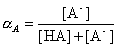 - мольная доля
диссоциированной формы кислоты)
- мольная доля
диссоциированной формы кислоты)
Коэффициент емкости вещества, присутствующего в виде равновесной
смеси форм, равен «средневзвешенному» из коэффициентов емкости отдельных форм.
Полный вывод этого выражения в задаче не требовался. Некоторые участники тем не
менее сделали это – и получили за свои труды по несколько «премиальных» баллов.
- Рассчитайте мольную долю бензойной кислоты HA16 (в
условиях хроматографического эксперимента), находящуюся в форме аниона A-.
Значение Kaдля HA16
равно 3,63.10-5.
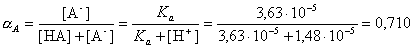
Комментарии, видимо, излишни. Это тот вопрос, на который, по
замыслу, должен был бы ответить каждый участник. Увы… Многие не брались вообще,
многие путали долю A-и HA.
P.S. Правильное решение применительно к условиям электрофоретического разделения мы тоже засчитывали.
- При хроматографировании смеси HA16 и HA18
коэффициент селективности α составил 1,012 (HA18
удерживается сильнее, чем HA16). Принимая для обеих кислот k’HA = 2,646 и k’A
= 0,128, рассчитайте Ka для HA18.
Рассчитаем из выражения п.2 значение k’ для HA16 ([H+] = 10-4,83 = 1,48.10-5
М):
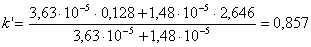
Для HA18k’ = 0,857.1,012 = 0,868
Из выражения п. 2 имеем:
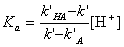 . Отсюда для HA18
. Отсюда для HA18 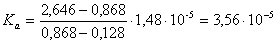
Видимо, тоже все понятно.
- Сколько теоретических тарелок необходимо, чтобы в
указанных условиях хроматографического эксперимента полностью разрешить
пики HA16 и HA18 (Rs = 1,5)?
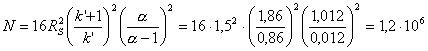 т.т. (в расчете
использовано среднее значение k’ для обеих кислот)
т.т. (в расчете
использовано среднее значение k’ для обеих кислот)
Эта стандартная формула есть в любом учебнике. Но надо еще
правильно ее применить. Основные ошибки – использовали неверное значение k’ (для индивидуальных форм) либо вообще
пренебрегали в расчете сомножителем, содержащим k’. В данном случае (при столь малых коэффициентах емкости) это
приближение – слишком грубое.
- Рассчитайте значение рН, при котором достигается
наибольшая селективность хроматографического разделения HA16 и HA18.
Из выражения п.2
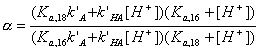 =
=
= 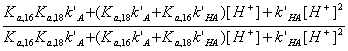 =
=
= 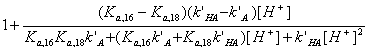 =
=
= 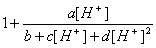
рН наибольшей селективности найдем, приравняв нулю dα/d[H+]:
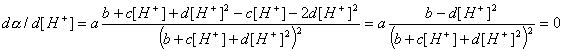
Отсюда 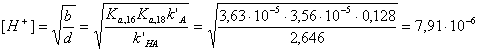 М и рН = 5,10.
М и рН = 5,10.
До идеи решения кое-кто дошел. А вот получить еще и правильный
численный ответ…
- Наилучшее хроматографическое разрешение пиков HA16 и HA18
достигается:
- при том же значении рН, что и наибольшая
селективность
- при более высоком рН
- при более низком рН
Выберите
правильный ответ и обоснуйте его.
Разрешение характеризуется величиной 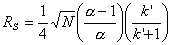 . «Лобовой» путь решения, аналогичный п. 6 (выражение всех
величин через [H+], дифференцирование по [H+] и т.д.) в конце концов приведет к успеху, но он крайне трудоемок.
Для ответа на поставленный вопрос достаточно найти знак производной dRS/dpH при значении рН, рассчитанном в п.6. Считая, что число
теоретических тарелок N от рН не зависит, имеем:
. «Лобовой» путь решения, аналогичный п. 6 (выражение всех
величин через [H+], дифференцирование по [H+] и т.д.) в конце концов приведет к успеху, но он крайне трудоемок.
Для ответа на поставленный вопрос достаточно найти знак производной dRS/dpH при значении рН, рассчитанном в п.6. Считая, что число
теоретических тарелок N от рН не зависит, имеем:
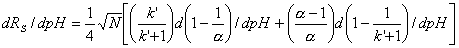
При рН максимальной селективности первый член суммы в квадратных
скобках равен нулю, а второй отрицателен (поскольку с увеличением рН растет
доля диссоциированной формы кислоты, k’ уменьшается, и величина 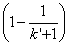 - тоже уменьшается).
Поэтому максимальное разрешение наблюдается при более низком значении рН, чем
максимальная селективность (численный расчет дает значение рН = 4,70 – ср. с рН
= 5,10 для максимальной селективности).
- тоже уменьшается).
Поэтому максимальное разрешение наблюдается при более низком значении рН, чем
максимальная селективность (численный расчет дает значение рН = 4,70 – ср. с рН
= 5,10 для максимальной селективности).
Среди вопросов по хроматографии этот оказался самым трудным.
Видимо, главная причина трудностей состояла в нечетком понимании того, что
хроматографическая селективность и хроматографическое разрешение – это разные
вещи.
P.S. Здесь и далее:
ответы на вопросы, для которых требовалось обоснование, рассматривали только
при наличии обоснования!
- Какой способ детектирования пиков бензойной
кислоты в указанных условиях хроматографического разделения Вам
представляется наилучшим: кондуктометрический, амперометрический,
фотометрический, рефрактометрический, флуориметрический? Обоснуйте свой
выбор.
Фотометрический в УФ-области. Амперометрическое и флуориметрическое
детектирование невозможны, поскольку ни бензойная кислота, ни бензоат-ион
неэлектроактивны и не способны к флуоресценции, рефрактометрический способ
детектирования характеризуется весьма низкой чувствительностью, а кондуктометрический – в данном случае тоже
(из-за малого различия в электропроводности буфера и определяемого вещества).
Распространенная ошибка – рассмотрение возможности того или иного
способа детектирования в отрыве от конкретного вещества с его конкретными
свойствами. Пусть способ X тысячу раз хорош сам по себе – но для данного вещества в данных
условиях он может быть неприменим!
- Оцените время миграции бензойной кислоты HA16 в
условиях электрофоретического эксперимента, исходя из следующих данных:
предельная эквивалентная электропроводность бензоат-иона l∞ = 3,24.10-3 м2.Ом-1.моль-1,
константа кислотной диссоциации бензойной кислоты Ka = 6,46.10-5, время миграции бензилового спирта t0 = 15,6 мин.
Для расчета времени миграции t воспользуемся следующими соотношениями:
t = l/v, где v – скорость
движения иона;
v = μE = μU/L, где E – напряженность электрического поля, U – приложенное
напряжение, μ – общая электрофоретическая подвижность;
μ =
μabs + μeof, где μabs -
абсолютная подвижность, μeof -
электроосмотическая подвижность;
μabs = l/(|z|F), где l - эквивалентная электропроводность, z – заряд иона, F – постоянная Фарадея.
Отсюда для |z| = 1 (бензоат-ион)
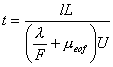
Величину l можно приближенно принять равной αAl∞, где αA – доля диссоциированной формы кислоты, а μeof рассчитать из значения t0
для незаряженного компонента – бензилового спирта (для него μabs = 0):
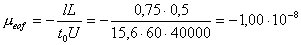 м2с-1В-1
м2с-1В-1
(знак
«минус» означает, что электроосмотический поток направлен противоположно
движению анионов, т.е. к катоду; в качестве условного положительного
направления выбрано направление к аноду).
Доля
диссоциированной формы бензойной кислоты в условиях эксперимента ([H+]
= 1,00.10-4 М) составляет
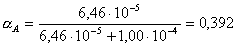
Отсюда
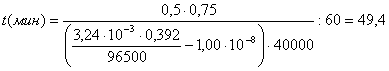 мин
мин
Начинается электрофорез. Это та часть задачи, которая требует уже
специальных знаний. А данный вопрос, кроме того – еще и логического мышления,
умения связывать воедино различные понятия, а также точности и аккуратности в
выкладках и вычислениях. В условии задачи намеренно была приведена
характеристика, обычно не используемая при описании электрофоретических
экспериментов, - предельная электропроводность. Как из нее оценить традиционную
электрофоретическую характеристику, электрофоретическую подвижность? Да хотя бы
из размерностей можно было бы догадаться!
- Как объяснить различие в величинах констант
кислотной диссоциации HA16, приведенных в условиях вопросов 3 и 9?
Наличием в растворе в условиях хроматографического разделения метанола,
уменьшающего диэлектрическую проницаемость среды и, соответственно, величины
констант кислотности.
Вопрос, требующий не только внимательного прочтения условий эксперимента,
но и грамотного их анализа. По крайней мере, факторы, которые заведомо не могут
повлиять на значение константы кислотности, - различие в рН растворов и наличие
электростатического поля – следовало бы сразу же исключить из рассмотрения.
- Как изменятся (увеличатся, уменьшатся, останутся
без изменения)
1)
времена миграции HA16 и HA18
2)
число теоретических тарелок
при
введении в раствор 0,1% гидроксипропилцеллюлозы (ГПЦ)? Объясните Ваш ответ.
Гидроксипропилцеллюлоза адсорбируется на
стенках капилляра и тем самым:
1)
подавляет
электроосмотический поток – времена миграции анионов уменьшатся;
2) препятствует адсорбции разделяемых ионов –
размывание пиков уменьшится, число теоретических тарелок увеличится;
Специфика капиллярного электрофореза – наличие такого явления, как
электроэндоосмотический поток, который направлен, как правило, к катоду.
Т.е. в данном случае – в направлении, противоположном движению ионов. Не
знающие этого могли бы по крайней мере догадаться о существовании чего-то
подобного из вопроса 9, где приведена величина времени миграции бензилового
спирта – незаряженного (!) соединения. Конечно, ГПЦ в какой-то мере
увеличивает вязкость раствора и тем самым вроде бы увеличивает время миграции.
Но эффект подавления электроосмотического потока все перекрывает.
- К какому электроду (катоду, аноду) движутся
анионы бензойной кислоты 1) в присутствии ГПЦ; 2) в отсутствие ГПЦ?
Объясните Ваш ответ.
В
присутствии гидроксипропилцеллюлозы электроосмотический поток подавлен,
бензоат-анионы движутся, как им и полагается, к аноду. В отсутствие
гидроксипропилцеллюлозы наблюдается электроосмотический поток, направленный к
катоду, но его скорость меньше, чем собственная скорость бензоат-анионов (см.
п.9) – бензоат-анионы движутся также к аноду (но с гораздо меньшей скоростью).
«катионы двигаются к катоду, а анионы - к аноду…» Так вот – не всегда!
Наличие электроосмотического потока может изменить картину на наоборот. И любые
разумные соображения на эту тему, будь они приведены в тексте ответа, конечно
же, не остались бы без соответствующей оценки. А вот изменится ли картина на
самом деле – это уже надо сравнивать скорость потока и собственную скорость
иона. Короче, надо считать. «Нельзя же так – на веру, нельзя же так – без
сметы, должны быть аргументы и численный расчет»!
Все
вопросы, оставшиеся непроясненными, рад буду обсудить лично. Пишите:
garmash@analyt.chem.msu.ru
С уважением
–
Гармаш
Андрей Викторович, доцент кафедры аналитической химии Химического факультета
МГУ.
Литература
- Основы
аналитической химии. В 2 кн. Кн. 1. Общие вопросы. Методы разделения. /Под
ред. Ю.А.Золотова. М.: Высшая школа, 2000. Гл. 5,6,8.
- Руководство
по капиллярному электрофорезу /Под ред. А.М.Волощука. М.: РАН, 1996.
- N.Tanaka, M.Araki // J. Amer.
Chem. Soc. 1985. V. 107. P. 7780.
- S.Terabe, T.Yashima, N.Tanaka,
M.Araki // Anal. Chem. 1988. V. 60. P.1673.
- K.K.-C.Yeung, C.A.Lucy
//Anal.Chem. 1998. V. 70. P.3286.
- А.Иващенко,
Г.Васильев. Норд-Ост. http://libretto.musicals.ru/text.php?textid=483&language=2


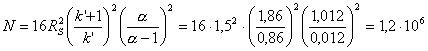 т.т. (в расчете
использовано среднее значение k’ для обеих кислот)
т.т. (в расчете
использовано среднее значение k’ для обеих кислот)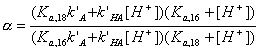 =
=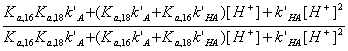 =
= 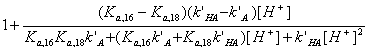 =
= 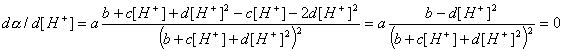
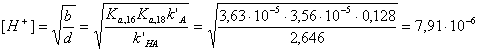 М и рН = 5,10.
М и рН = 5,10.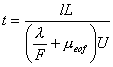
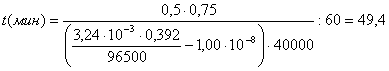 мин
мин