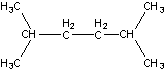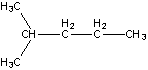Школьные олимпиады по химии
LX Московская городская олимпиада школьников по химии
Городской этап
2003/2004 уч. год
Задания 10 класса
10-1 Качественный анализ минерала леонита
показал присутствие в нем ионов калия, магния и
сульфат-ионов. При прокаливании образца минерала
массой 7,32 г его масса уменьшается на 1,44 г. Такая
же навеска минерала при растворении в воде и
последующем прибавлении избытка раствора
хлорида бария образует 9,32 г осадка.
Определите формулу леонита.
10-2 Смесь этана, этилена и пропена имеет
плотность по водороду 15,9. К 1 литру этой смеси
добавили 1 литр водорода и пропустили полученную
смесь над платиновым катализатором. Общий объем
газов на выходе из реактора составил 1,5 л.
Рассчитайте состав исходной смеси углеводородов
в процентах по объему, считая что реакция прошла
количественно (все объемы измерены при н.у.).
10-3 При взаимодействии смеси двух
монобромалканов с металлическим натрием
получена смесь углеводородов А, Б и В
(в порядке возрастания молекулярной массы).
Бромированием А можно получить два изомерных
монобромпроизводных с плотностью по воздуху 4,72.
Бромирование В приводит к трем продуктам с
плотностью по воздуху 6,66.
1. Определите структурные формулы всех
упомянутых веществ.
2. Приведите уравнения реакций
3. Как Вы думаете, какой из трех продуктов
бромирования углеводорода В образуется в
большем количестве и почему?
10-4 Газ А получается при нагревании
кусочков парафина с простым веществом Х. Газ Б
образуется при взаимодействии некоторых
металлов с кислотой В в присутствии паров
воды. Газы А и Б реагируют друг с другом в
объемном отношении 2:1, при этом получается
вещество Х.
О каких веществах идет речь? Напишите уравнения
упомянутых реакций.
10-5 Перед вами отрывок из книги Астрид
Линдгрен "Приключения Калле Блюмквиста", в
котором пропущены некоторые слова или
словосочетания.
– Это обыкновенная колба, в которую я наливаю
_____ и кладу несколько кусочков ___. Тут выделяется
водород, так? Если теперь сюда ввести мышьяк в
каком угодно виде, то получится газ _____. Отсюда
газ поступает для просушивания в трубку с сухим
______, а затем вот в эту узенькую трубочку. Здесь мы
подогреваем газ на спиртовке, и он распадается на
_____ и _____. Причем _____ оседает на стенках трубки в
виде блестящего серо-черного налета. Так
называемое мышьяковое _____ – надеюсь, вы о нем
слышали, мой молодой друг. Его молодой друг
вообще ни о чем не слышал, но он с неослабевающим
интересом следил за всеми приготовлениями. – Но
не забудьте – я вовсе не утверждаю, что в
шоколаде действительно есть мышьяк,– заметил
Калле, когда он наконец зажег спиртовку.– Просто
я для порядка делаю небольшой опыт и искренне
надеюсь, что мои подозрения неосновательны.
1. Вставьте пропущенные слова
2. Напишите уравнения реакций
3. Возможно, Вы знаете как называется указанный
метод обнаружения мышьяка. В каких материалах
определяют мышьяк (качественно и количественно)
и для чего?
10-6 Простое вещество А
взаимодействует с жидкостью, состоящей из
элементов Б и В. При этом выделяется газ Б2,
а из раствора можно выделить легко возгоняющееся
вещество состава АВ3, содержащее 33,33%
элемента В. АВ3 реагирует с газом Б2,
образуя при этом вещество А и другое
соединение элементов Б и В.
Определите, о каких веществах идет речь. Напишите
уравнения реакций.
РЕШЕНИЯ
10-1.При прокаливании образца удаляется
кристаллизационная вода.
Определим ее массу: 7,32 - 1,44 = 5,88 г.
При добавлении хлорида бария получается сульфат
бария:
М = 233, n = 9,32 / 233 = 0,04 моль.
Таким образом, исходная навеска содержит 0,04 моль
сульфат-ионов. Масса сульфат-ионов в навеске - 3,84
г, масса суммы металлов - 2,04 г.
Для вычисления формулы минерала составим
систему уравнений:
2 n (Mg) + n (K) = 2 n (SO42-) (условие
электронейтральности).
24 n (Mg) + 39 n (K) = 2,04
(масса металлов в навеске минерала).
Решая систему уравнений, получаем n
(Mg) = 0,02, n (K) = 0,04.
Соотношение K : Mg : SO4 = 2 : 1 : 2. Таким образом,
формула – K2Mg(SO4)2. Теперь надо
найти количество кристаллизационной воды. 1,44 г
воды составляет 0,08 моль - в два раза больше, чем
число моль сульфата.
Следовательно, формула леонита - K2Mg(SO4)2
• 4 H2O
10-2.При пропускании смеси над платиновым
катализатором происходит гидрирование этилена и
пропилена, этан остается без изменений.
Пусть смесь содержит X л этана, Y л этилена и Zл
пропилена.
C2H4 + H2 = C2H6
C3H6 + H2 = C3H8
Так как 1 объем углеводорода реагирует с 1
объемом водорода и в результате получается 1
объем, то уменьшение объема смеси (0,5 л)
соответствует объему прореагировавшего
водорода, а также суммарному объему этилена и
пропилена в смеси.
Таким образом, Y + Z = 0,5. Так как общий объем смеси 1
литр, то X = 1 - 0,5 = 0,5.
Плотность смеси по водороду записывается
следующим образом:
X • 15 + 14 Y + 21 Z = 15,9, (X, Y и Z представляют собой
объемные доли соответствующих углеводородов в
смеси, так как объем смеси 1 л, а 15, 14 и 21 - это
плотности по водороду этана, этилена и пропилена
соответственно). Так как X = 0,5, получаем
0,5 • 15 + 14 Y + 21 Z = 15,9
14 Y + 21 Z = 8,4. Кроме того, известно, что
Y + Z = 0,5
Решение системы уравнений дает Y = 0,3, Z = 0,2.
Таким образом, исходная смесь содержит 50% этана,
30% этилена и 20% пропилена.
10-3. 1) Пусть формулы исходных веществ R1Br
и R2Br
Тогда углеводороды А, Б и В имеют
формулы R1– R1, R1– R2, и R2–
R2
Молярная масса продуктов бромирования
углеводорода А равна 137, за вычетом брома (80)
плюс водород (1) получаем молярную массу А, это 58, A
= C4H10
Молярная масса продуктов бромирования В
равна 193, минус 80 плюс 1 дает 114, это соответствует В
= C8H18. Очевидно, что Б = C6H14.
Исходные бромиды - C2H5Br и C4H9Br.
Определить структурные формулы можно на
основании того, что А образует два
монобромпроизводных, а В - три. Кроме того,
молекулы А и В должны быть симметричными.
Вещество А - н-бутан (молекула изобутана
несимметрична)
Симметричные изомеры октана:
н-октан CH3CH2CH2CH2CH2CH2CH2CH3
- дает четыре разных продукта при бромировании.
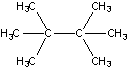
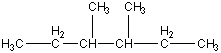
Данные изомеры могут образовать
соответственно одно и четыре
монобромпроизводных.
Таким образом, структурная формула вещества В
:
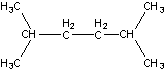
Вещество Б:
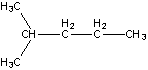
Исходные бромиды: RBr: CH3CH2Br и (CH3)2CHCH2Br.
2) Уравнения реакций:
реакция Вюрца C2H5Br + C4H9Br + Na
® C4H10 + C6H14
+ C8H18 + NaBr
Бромирование углеводородов RH + Br2 = RBr + HBr
3) На относительные количества продуктов
замешения влияют два фактора. Первый факор — это
высокая подвижность атома водорода при
третичном атоме С (группы CH) по сравнению с
вторичным (группы CH2) и первичным (группы CH3).
С другой стороны, количество атомов Н при
первичном С атоме — 12, при вторичном – 4, а при
третичном – только 2. Видно, что эти факторы
действуют в противоположных направлениях,
поэтому предсказать окончательный результат
сложно, не зная во сколько раз константа скорости
реакции для третичного атома больше, чем для
первичного или для вторичного.
10-4.А = сероводород
Х = сера
Б = SO2
В = конц. серная кислота
Реакции: C40H82 + 41 S = 41 H2S + 40 С
Cu + 2 H2SO4 = SO2 + CuSO4 + 2 H2O
SO2 + 2 H2S = 3 S + 2 H2O
10-5.
1. (1) соляная кислота (или другая, которая
пригодна для получения водорода – в смысле не
азотная)
(2) - цинк (или другой металл, который
взаимодействует с кислотой с выделением
водорода)
(3) AsH3 (арсин)
(4) хлорид кальция или любой другой осушитель
(5), (6) мышьяк и водород или водород и мышьяк
(7) мышьяк
(8) зеркало
2. Можно написать несколько вариантов
реакций.
Например, Zn + 2HCl = ZnCl2 + H2
AsO33- + 9 H (атомарный водород) = AsH3
+ 3 H2O
другой вариант: K3AsO3 + 3 Zn + 9 HCl = 3 ZnCl2
+ AsH3 + 3 H2O + 3 KCl
2 AsH3 = 2 As + 3 H2.
3. Мышьяк определяют в объектах окружающей
среды, так как он токсичен и на его содержание
разработаны нормы (ПДК) для различных объектов.
Примерами объектов окружающей среды могут быть
вода, почва, воздух. Содержание мышьяка
определяют также в пищевых продуктах. Здесь речь
идет о количественном определении. В области
криминалистики мышьяк определяют в связи со
случаями отравления — например, в описанном выше
примере предполагалось, что мышьяк был добавлен
в шоколад. Если человек был отравлен, то наличие
мышьяка в тканях (обычно в волосах) покажет, что
отравление произошло именно мышьяком В этих
случаях достаточно качественного определения.
10-6.
1) Предположительно, АВ3 является оксидом. (В
= кислород)
Определим молярную массу элемента А (х)
48 / (х + 48) = 0,3333. Отсюда х = 96. Элемент - молибден.
Таким образом, А = молибден,
Б и В = водород и кислород. Жидкость, состоящая из
них - H2O2.
AB3 = MoO3
Другое соединение элементов Б и В - вода.
2) Реакции
Mo + 2 H2O2® MoO3 + H2
+ H2O либо 2 Mo + 3 H2O2®
2 MoO3 + 3 H2
MoO3 + 3 H2 = Mo + 3H2O.