|
ВОЗБУДИМЫЕ
БИОЛОГИЧЕСКИЕ МЕМБРАНЫ.
МОДИФИЦИРОВАННАЯ
ОДНОЦЕНТРОВАЯ МОДЕЛЬ
МЕМБРАННОГО
РЕЦЕПТОРА
А.П. Полтораков
Институт химической физики им. Н.Н. Семенова РАН
Возбудимые биологические мембраны
играют основную роль в процессах передачи и обработки информации в живом
организме. Исследование структуры возбудимых биологических мембран нервных
и мышечных клеток необходимо для понимания молекулярных механизмов целого
ряда физиологических явлений и процессов: передачи нервного импульса, сокращения
мышц, действия на биосистемы различных физиологически активных соединений
[1–14]. В основе всех этих явлений лежат механизмы ионной проницаемости
мембран, структурно обеспечиваемые ионными каналами и регуляторами прохождения
ионов через каналы – мембранными рецепторами [13,14]. Рецепторы, встроенные
в структуру каналов, способны либо их открывать либо закрывать, что приводит
к изменению проницаемости мембран для соответствующих ионов, возникновению
ионных токов и прохождению импульса возбуждения [12,15]. Поэтому исследование
структуры рецепторов как составной части мембран необходимо для понимания
механизма воздействия различных биологически активных соединений на возбудимые
мембраны и их роли в процессах передачи или, наоборот, торможения возбуждения
мембран.
Взаимодействие мембранных
рецепторов только с определенными биохимическими соединениями – медиаторами
(ацетилхолин, адреналин и др.) обеспечивает возникновение процесса возбуждения
в ответ на строго специфические физиологические стимулы, что и определяет
передачу в организме строго биологической информации. Исследование этих
процессов позволяет выяснить механизмы взаимодействия физиологически активных
соединений с биомембранами, а также расшифровать тонкую молекулярную структуру
рецепторов как одних из основных компонентов клеточных мембран.
Для качественного и количественного
описания взаимодействия физиологически активных соединений с рецепторами
мембран широко используется теория рецепторов [3–9,12,14]. Согласно этой
концепции, биологический эффект, вызываемый в биосистеме каким-либо воздействием,
например, физиологически активным соединением, является следствием сложной
цепи процессов, где основное звено представлено химическими превращениями
специфического структурного элемента системы – рецептора. Теория рецепторов
позволяет проводить количественный анализ регистрируемых при этом кривых
“доза-эффект”, отражающих зависимость биологического ответа системы от
концентрации (дозы) действующего соединения.
Первая количественная модель
рецепторной теории была создана Кларком для описания зависимости амплитуды
сокращения мышцы от концентрации добавленного в систему медиатора возбуждения
– ацетилхолина [1]. В ее основе лежит обратимая химическая реакция между
медиатором возбуждения или в общем случае агонистом (A)
и рецептором (R) мышечной мембраны,
сопровождающаяся образованием комплекса агонист-рецептор (AR):
KA
A + R  AR
AR
где KA
– константа равновесия реакции комплексообразования.
Кларк впервые предположил,
что амплитуда мышечного сокращения y пропорциональна концентрации комплекса
агонист-рецептор AR [1]. Для
произвольного эффекта y постулат Кларка записывается в виде [7,8]:
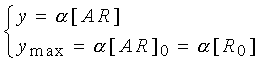 при
при 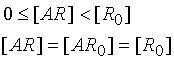 ,
(1) ,
(1)
где a
– коэффициент пропорциональности (коэффициент механохимического сопряжения
в случае мышечного сокращения); ymax
– максимально возможная амплитуда мышечного сокращения, при которой заняты
(оккупированы) все рецепторы; [R0]
– общая концентрация рецепторов.
Для условий равновесия уравнение
Кларка, описывающее явление полного агонизма, имеет вид:
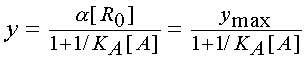 .
(2) .
(2)
Полученная зависимость отражает
общие закономерности экспериментальных кривых “доза-эффект” для полных
агонистов: постепенное нарастание эффекта от нуля до его предельного (максимального)
значения с увеличением концентрации агониста. Уравнение Кларка лежит в
основе одноцентровой модели рецептора, т.к. при его выводе предполагается
взаимодействие с рецептором, имеющим единственный активный центр. Одноцентровая
модель позволяет анализировать и более сложные случаи: суммарное действие
двух агонистов, конкурентного антагонизма двух соединений и др. [3].
Стефенсон [2] первым обратил
внимание на количественное несоответствие уравнения Кларка (2) экспериментальным
кривым “доза-эффект”. Можно привести уравнения теории рецепторов в соответствие
с экспериментальными кривыми “доза-эффект”, если применять для описания
взаимодействия физиологически активного вещества с рецептором более общие
(чем постулат Кларка в его простейшем виде) уравнения связи, устанавливающие
зависимость между биологическим эффектом и концентрацией комплекса агонист-рецептор.
В настоящей работе на основе
общих уравнений связи модифицирована одноцентровая модель рецептора и найдены
уравнения, наилучшим образом описывающие явления полного агонизма.
ОДНОЦЕНТРОВАЯ МОДЕЛЬ
KA
A + R  R
(3) R
(3)
В основе одноцентровой модели
лежит представление о рецепторе (R) как структуре с одним активным центром,
взаимодействие с которым соединения-агониста A приводит к образованию комплекса
AR и, как следствие, биологическому ответу (y) – мышечному сокращению,
что описывается реакцией (3) с константой равновесия KA.
Решая кинетическое уравнение этой реакции и используя постулат Кларка,
можно получить кривую “доза-эффект” для агониста в относительных координатах
в виде зависимости y/ymax
от [A]:
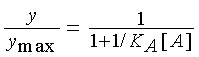 .
(4) .
(4)
Ее удобно анализировать в
обратных координатах ymax/y
от 1/ [A]:
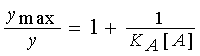 ,
(4a) ,
(4a)
где зависимость (4a) представляет
прямую линию, отсекающую на оси ординат отрезок a, равный 1 (пунктирная
прямая 2 на рис. 1B).
Сравнение с опытными данными
показывает, что экспериментальные кривые описываются несколько иными зависимостями
(рис. 1A,C):
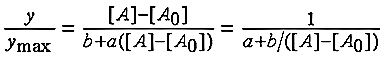 ; ; 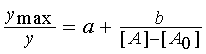 ,
(5,6) ,
(5,6)
где a = 0,689, b = 7,97·10–8
моль/л, [A0] =
1,18·10–8
моль/л, [A]max = 2,68·10–7
моль/л. Здесь a – отрезок, отсекаемый прямой на оси ординат (обратные координаты);
b – тангенс угла наклона этой прямой; [A0]
– пороговая концентрация агониста, при превышении которой возникает эффект:
y і 0 при
[A] і [A0]; [A]max –
концентрация агониста, по достижении которой эффект становится максимальным:
y = ymax при [A] = [A]max
(рис. 1А).
Кривые “доза-эффект” получены на 100 изолированных гладкомышечных препаратах
подвздошной кишки морской свинки, сокращающихся под действием ацетилхолина
[18]. Параметры экспериментальной кривой a, b, [A0]
найдены методом наименьших квадратов [17] с использованием компьютерных
вычислений и программ “Mathcad 8.”
Таким образом, коэффициент
a экспериментальной зависимости (5,6) меньше 1, что не соответствует уравнению
Кларка (2). Кроме того, спрямление происходит в координатах 1/([A] – [A0])
(рис.
1C), и в уравнениях появляются
новые параметры – пороговая и максимальная концентрации агониста, последняя
– в неявном виде.
Наличие пороговой и максимальной
концентраций агониста указывает на то, что уравнение связи в виде простейшего
постулата Кларка (1) отражает не все особенности действия агонистов. Нами
показано, что постулат Кларка является частным случаем более общих уравнений
связи, учитывающих пороговые явления и наличие резерва рецепторов [10,11]:
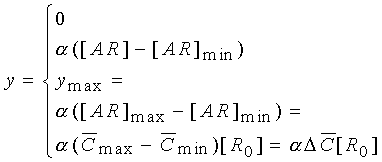 при
при 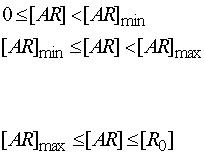 ,
(7) ,
(7)
где [AR]min–
минимальная (пороговая) концентрация рецепторов или их комплексов с агонистом,
начиная с которой возникает эффект; 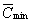 =
[AR]min/[R0] – относительная
минимальная (пороговая) концентрация рецепторов; [AR]max
– концентрация рецепторов, при достижении которой эффект становится максимальным
([AR]max Ј
[R0]); =
[AR]min/[R0] – относительная
минимальная (пороговая) концентрация рецепторов; [AR]max
– концентрация рецепторов, при достижении которой эффект становится максимальным
([AR]max Ј
[R0]); 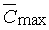 =
[AR]max/[R0] – относительная
максимальная концентрация рецепторов; =
[AR]max/[R0] – относительная
максимальная концентрация рецепторов; 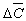 – разность между относительными максимальной и минимальной концентрациями
рецепторов; a
– коэффициент пропорциональности, являющийся для модели мышечного сокращения
коэффициентом механо-химического сопряжения.
– разность между относительными максимальной и минимальной концентрациями
рецепторов; a
– коэффициент пропорциональности, являющийся для модели мышечного сокращения
коэффициентом механо-химического сопряжения.
Графически уравнения связи
показаны на рис. 2. Они
предусматривают существование пороговых концентраций рецепторов [AR]min
и, как следствие, пороговых концентраций агониста [A0].
Биологический смысл наличия пороговых эффектов – отсекать “шумы”, обеспечивая
инерционность биосистемы и ее устойчивость к сверхмалым воздействиям.
Другой особенностью уравнений
связи является наличие максимальной концентрации рецепторов – [AR]max,
меньшей либо равной их общей концентрации. За счет этого формируется резерв
рецепторов – rr, равный разности концентраций [R0]
и [AR]max (рис.
2):
[rr] = [R0] – [AR]max
(8)
или относительный резерв
рецепторов 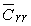 : :
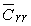 =
[rr]/ [R0] = 1 – =
[rr]/ [R0] = 1 – 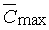 .
(9) .
(9)
При оккупации агонистом резерва
рецепторов эффект не меняется и остается максимальным. Впервые идею о наличии
резерва рецепторов высказал Стефенсон [2]. Доказательством его существования
являются опыты по необратимому выключению рецепторов с помощью соединений,
образующих с ними ковалентные связи: при блокировании рецепторов из резерва
способность мышцы к максимальному ответу сохраняется [3,25]. Как пример
можно привести эксперименты по выявлению резерва опиатных рецепторов подвздошной
кишки морской свинки с помощью алкилирующего соединения b
-хлорналтрексамина [26], резерва М-холинорецепторов продольной мышцы тонкой
кишки морской свинки с помощью необратимого блокатора бензилилхолиниприта
[6].
Область резерва рецепторов
(rr) на рис. 2А заштрихована.
Биологический смысл резерва рецепторов – повышение надежности функционирования
биосистемы. В модели Кларка резерв рецепторов отсутствует, и максимальный
эффект достигается оккупацией агонистом всех рецепторов: [rr] = 0 и [AR]max
= [R0]. В этой
модели отсутствуют и пороговые эффекты: 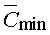 =
0 и [A0] = 0. Поэтому постулат
Кларка (1) является частным случаем общих уравнений связи, что изображено
на рис.
2А пунктиром 4. Здесь же представлены другие частные
случаи: постулат Кларка, учитывающий пороговые эффекты (кривая 2), и полностью
пороговые зависимости, соответствующие условию [AR]min
= [AR]max и
закону “все или ничего” (кривая 3). =
0 и [A0] = 0. Поэтому постулат
Кларка (1) является частным случаем общих уравнений связи, что изображено
на рис.
2А пунктиром 4. Здесь же представлены другие частные
случаи: постулат Кларка, учитывающий пороговые эффекты (кривая 2), и полностью
пороговые зависимости, соответствующие условию [AR]min
= [AR]max и
закону “все или ничего” (кривая 3).
Применяя общее уравнение
связи (7), выведем зависимость “доза-эффект” при наличии резерва рецепторов
и пороговой (минимальной) концентрации комплексов. Для этого используем
уравнение для равновесной концентрации комплекса агонист-рецептор:
[AR] = KA [A] [R],
(10)
где [R] – концентрация свободных
рецепторов; уравнение материального баланса для общей концентрации рецепторов:
[R0] = [R] + [AR],
(11)
уравнения для концентраций
агониста [A] и [A0], вытекающие
из (8–11):
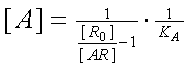 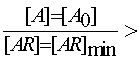 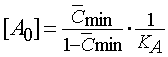 .
(12,13) .
(12,13)
Последние два уравнения позволяют
вычислить разность [A] – [A0]
и с помощью уравнения связи (7) y = a
([AR] – [AR]min) получить зависимость
эффекта от разности концентраций агониста:
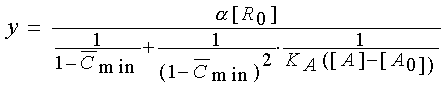 .
(14) .
(14)
Найденное уравнение можно
выразить в относительных координатах, учитывая из (7) связь максимального
эффекта с общей концентрацией рецепторов 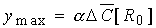 : :
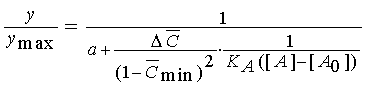 ,
(15) ,
(15)
где 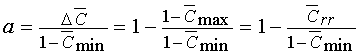 . .
В обратных координатах:
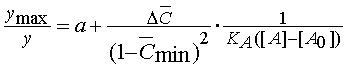 .
(16) .
(16)
Таким образом, получены теоретические
уравнения одноцентровой модели, соответствующие экспериментальной зависимости
(5,6) для полных агонистов со следующими значениями параметров:
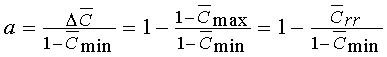 ; ; 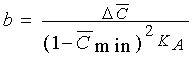 ;
(17) ;
(17)
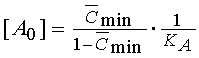 , , 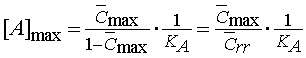 . .
Из найденных уравнений следует,
что вид кривых “доза-эффект” определяется параметрами уравнений связи и
реакции взаимодействия агониста с рецептором. Из них основными являются
относительный резерв рецепторов 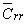 и
константа равновесия KA.
Поэтому анализ уравнений (15–17) проведем с помощью варьирования этих двух
параметров, значение которых можно определить из экспериментальных кривых
(5,6). Вначале рассмотрим влияние величины и
константа равновесия KA.
Поэтому анализ уравнений (15–17) проведем с помощью варьирования этих двух
параметров, значение которых можно определить из экспериментальных кривых
(5,6). Вначале рассмотрим влияние величины 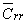 –
кривые (1–4) на рис.
3А,B. –
кривые (1–4) на рис.
3А,B.
Кривая (1): 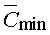 =
0.1, =
0.1, 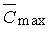 = 0.721, = 0.721, 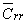 =
0.279, KA = 9.6·106
л/моль. Эти величины рассчитаны по формулам, полученным из (17): =
0.279, KA = 9.6·106
л/моль. Эти величины рассчитаны по формулам, полученным из (17):
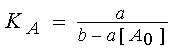 ; ; 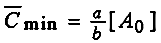 ;
(18) ;
(18)
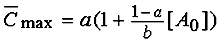 ; ; 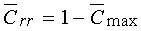 , ,
где значения a, b, [A0]
взяты из экспериментальной зависимости (5,6).
При анализе кривой (1) необходимо
отметить очень хорошее соответствие теоретической зависимости (15) опытным
данным: в обратных координатах экспериментальные точки точно ложатся на
прямую, отсекающую на оси ординат отрезок a = 1 – (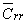 /1– /1– 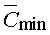 ),
меньший единицы (рис.
1C). Поэтому прямая по отношению к единице смещена вниз
по оси ординат, причем смещение определяется в основном величиной резерва
рецепторов: чем он больше, тем смещение больше. Таким образом, основная
причина отклонения кривых от уравнения Кларка – наличие резерва рецепторов,
составляющего 28% от их общего количества. Большое значение ),
меньший единицы (рис.
1C). Поэтому прямая по отношению к единице смещена вниз
по оси ординат, причем смещение определяется в основном величиной резерва
рецепторов: чем он больше, тем смещение больше. Таким образом, основная
причина отклонения кривых от уравнения Кларка – наличие резерва рецепторов,
составляющего 28% от их общего количества. Большое значение 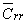 в
гладких мышцах связано с их тоничностью – способностью поддерживать постоянный
мышечный тонус достаточно продолжительное время, что достигается функционированием
мышцы в области резерва рецепторов, где сокращение максимально. в
гладких мышцах связано с их тоничностью – способностью поддерживать постоянный
мышечный тонус достаточно продолжительное время, что достигается функционированием
мышцы в области резерва рецепторов, где сокращение максимально.
Рассмотрим поведение кривой
(1) при больших концентраций агониста: при 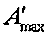 =
2,68·10–7 моль/л эффект принимает
максимальное значение, т.к. оккупируется количество рецепторов [AR]max,
необходимое для получения максимального эффекта. После этого начинается
область резерва рецепторов =
2,68·10–7 моль/л эффект принимает
максимальное значение, т.к. оккупируется количество рецепторов [AR]max,
необходимое для получения максимального эффекта. После этого начинается
область резерва рецепторов 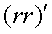 ,
и увеличения эффекта не происходит. ,
и увеличения эффекта не происходит.
Еще один параметр кривой
– пороговая концентрация агониста [A0],
определяемая минимальной концентрацией рецепторов 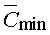 =
0,1. Это означает, что для получения минимального эффекта необходимо активировать
свыше 10% рецепторов. Наличие пороговой концентрации приводит к тому, что
кривая (1) выходит не из начала координат, а из точки [A0]
= 1,2·10–8 моль/л. =
0,1. Это означает, что для получения минимального эффекта необходимо активировать
свыше 10% рецепторов. Наличие пороговой концентрации приводит к тому, что
кривая (1) выходит не из начала координат, а из точки [A0]
= 1,2·10–8 моль/л.
Кривая (2). Получена
с уменьшенным в два раза резервом рецепторов: 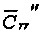 =
0,14, =
0,14, 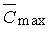 =
0,86 и не изменившейся [A0].
В результате происходит увеличение максимальной концентрации агониста до
значения =
0,86 и не изменившейся [A0].
В результате происходит увеличение максимальной концентрации агониста до
значения 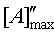 =
6,4·10–7 моль/л, и кривая “доза-эффект”
сдвигается вправо по оси абсцисс, т.к. требуется большее количество агониста
для достижения максимальной концентрации занятых рецепторов (уравнение
17). Уменьшенный в два раза резерв рецепторов показан на графике заштрихованной
областью =
6,4·10–7 моль/л, и кривая “доза-эффект”
сдвигается вправо по оси абсцисс, т.к. требуется большее количество агониста
для достижения максимальной концентрации занятых рецепторов (уравнение
17). Уменьшенный в два раза резерв рецепторов показан на графике заштрихованной
областью 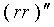 .
В обратных координатах прямая (2) в связи с уменьшением резерва рецепторов
поднимается вверх по оси ординат. .
В обратных координатах прямая (2) в связи с уменьшением резерва рецепторов
поднимается вверх по оси ординат.
Кривая (3): 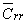 =
0, =
0, 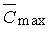 =
1. Резерв рецепторов отсутствует, максимальная концентрация по уравнению
(17) принимает бесконечно большое значение – =
1. Резерв рецепторов отсутствует, максимальная концентрация по уравнению
(17) принимает бесконечно большое значение – 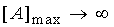 ,
и максимальный эффект достижим только в пределе: y —> ymax
и y/ymax —> 1. В обратных
координатах прямая еще выше поднимается вверх по оси ординат и стремится
к точке a = 1, что на графике рис.
3B обозначено стрелкой. Уравнение этой прямой соответствует
уравнению Кларка, учитывающему пороговый эффект: ,
и максимальный эффект достижим только в пределе: y —> ymax
и y/ymax —> 1. В обратных
координатах прямая еще выше поднимается вверх по оси ординат и стремится
к точке a = 1, что на графике рис.
3B обозначено стрелкой. Уравнение этой прямой соответствует
уравнению Кларка, учитывающему пороговый эффект:
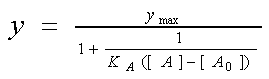 .
(19) .
(19)
Кривая (4): 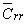 =
0 и =
0 и 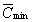 = 0. Отсутствуют
резерв и пороговая концентрация рецепторов. Кривая полностью соответствует
уравнению Кларка (2), выходит из начала координат и спрямляется только
в обратных координатах ymax/y
от 1/[A]. = 0. Отсутствуют
резерв и пороговая концентрация рецепторов. Кривая полностью соответствует
уравнению Кларка (2), выходит из начала координат и спрямляется только
в обратных координатах ymax/y
от 1/[A].
Исходя из полученных значений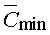 , ,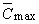 и
и 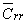 можно
реконструировать уравнение связи в относительных координатах [AR]/[R0]
– рис. 2B.
На графике показаны прямые 1–3, соответствующие последовательному уменьшению
резерва рецепторов до нуля, и пунктирная прямая 4, выходящая из начала
координат и построенная по постулату Кларка. можно
реконструировать уравнение связи в относительных координатах [AR]/[R0]
– рис. 2B.
На графике показаны прямые 1–3, соответствующие последовательному уменьшению
резерва рецепторов до нуля, и пунктирная прямая 4, выходящая из начала
координат и построенная по постулату Кларка.
Уравнение одноцентровой модели
позволяет проследить поведение кривых “доза-эффект” при варьировании кинетического
параметра – константы равновесия KA
и постоянных 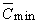 , ,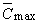 и
и  . В прямых
координатах при уменьшении KA
происходит параллельный сдвиг кривых “доза-эффект” в сторону больших концентраций
– рис.
4А. При этом по уравнению (17) увеличиваются и пороговые,
и максимальные концентрации агониста, что связано с уменьшением его сродства
к рецептору. В координатах ymax/y
от 1/[A] кривые ”доза-эффект” с разными значениями KA
представляют семейство прямых линий с изменяющимся углом наклона, выходящих
из точки a = 1 – . В прямых
координатах при уменьшении KA
происходит параллельный сдвиг кривых “доза-эффект” в сторону больших концентраций
– рис.
4А. При этом по уравнению (17) увеличиваются и пороговые,
и максимальные концентрации агониста, что связано с уменьшением его сродства
к рецептору. В координатах ymax/y
от 1/[A] кривые ”доза-эффект” с разными значениями KA
представляют семейство прямых линий с изменяющимся углом наклона, выходящих
из точки a = 1 –  /(1– /(1–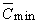 )
– рис. 4B,C.
В координатах ymax/y
от 1/([A] – [A0]) объединить
эти кривые нельзя, т.к. [A0]
зависит от константы равновесия. Прямолинейный характер зависимости сохраняется
для больших концентраций агониста, когда [A] >> [A0]
и )
– рис. 4B,C.
В координатах ymax/y
от 1/([A] – [A0]) объединить
эти кривые нельзя, т.к. [A0]
зависит от константы равновесия. Прямолинейный характер зависимости сохраняется
для больших концентраций агониста, когда [A] >> [A0]
и 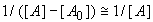 . При малых значениях
[A] прямые искривляются из-за влияния пороговой концентрации [A0]
– рис.
1B. . При малых значениях
[A] прямые искривляются из-за влияния пороговой концентрации [A0]
– рис.
1B.
Как пример параллельного
сдвига кривых “доза-эффект” вдоль оси концентраций при изменении константы
равновесия приведены результаты экспериментов Ариенса, выполненных на отрезках
тощего кишечника крысы [4]. Исследована серия агонистов от тетраметиламмония
до ацетилхолина, для которой наблюдался подобный эффект (рис.
5A). Параметры теоретических кривых рассчитаны по формулам
(18) и приведены в таблице.
Из нее следует, что по мере редуцирования молекулы ацетилхолина до иона
тетраметиламмония происходит последовательное уменьшение (приблизительно
на три порядка) константы сродства к активному центру рецептора. При этом
параметры уравнений связи 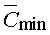 , , 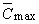 и и 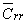 остаются
практически одинаковыми, т.к. эксперименты проводились на одном и том же
объекте. Это позволяет построить в логарифмических координатах линейные
зависимости пороговой и максимальной концентраций агониста от KA
(уравнения 17): остаются
практически одинаковыми, т.к. эксперименты проводились на одном и том же
объекте. Это позволяет построить в логарифмических координатах линейные
зависимости пороговой и максимальной концентраций агониста от KA
(уравнения 17):
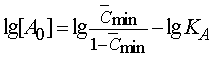 ; ; 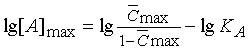 .
(20) .
(20)
Графики уравнений (20) представляют
собой параллельные друг другу прямые с тангенсом угла наклона, равным минус
единице – рис. 5B. Эти прямые
отражают параллельный сдвиг кривых “доза-эффект” при изменении константы
сродства агониста к рецептору.
Уменьшение KA
в данном ряду соединений обусловлено структурой М-холинорецептора, имеющего
в активном центре как минимум два участка: анионный и эстератический [5,14,16].
С первым взаимодействует положительно заряженный четвертичный азот молекулы
агониста, со вторым – карбонильный и эфирный атомы кислорода. Взаимодействие
с этими участками молекулы физиологического агониста – ацетилхолина обеспечивает
его специфичность и высокое сродство к холинорецептору. Поэтому последовательное
уменьшение KA при редуцировании
молекулы ацетилхолина до тетраметиламмония связывается с постепенным уменьшением
его взаимодействия с эстератическим участком активного центра холинорецептора.
Ионы тетраметиламмония способны взаимодействовать только с анионным участком
активного центра и имеют поэтому самое низкое значение константы сродства.
Аналогичным образом ведет
себя и другой важный концентрационный параметр кривых “доза-эффект” – 50%-ная
эффективная концентрация агониста:
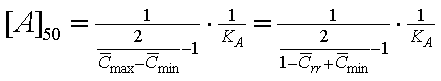 .
(21) .
(21)
[A]50 также определяется
при постоянных 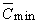 , ,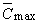 и
и 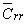 величиной
константы равновесия KA.
В логарифмических координатах зависимость (21) является линейной, расположена
посередине между прямыми для [A0]
и [A]max (рис.
5B) и имеет важное практическое значение. С ее помощью
можно определять величину константы равновесия: величиной
константы равновесия KA.
В логарифмических координатах зависимость (21) является линейной, расположена
посередине между прямыми для [A0]
и [A]max (рис.
5B) и имеет важное практическое значение. С ее помощью
можно определять величину константы равновесия:
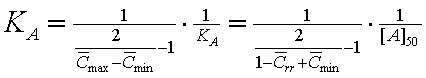 .
(21а) .
(21а)
Многие исследователи [3,12,16],
определяют константу равновесия из уравнения Кларка (2), согласно которому
KA= 1/[A]50.
Последнее равенство справедливо лишь при отсутствии резерва рецепторов
(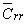 = 0 ) и беспороговых
кривых “доза-эффект” ( = 0 ) и беспороговых
кривых “доза-эффект” (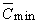 = 0), что практически не осуществляется. Отличие от истинной величины KA
может достигать значительных величин. Так, при экспериментальном значении
[A]50= 4,4·10–7
моль/л KA= 1/[A]50 = 2,2·106
л/моль, что более чем в четыре раза меньше истинного значения константы
равновесия, рассчитанного по уравнению (21а) – 9,6·106
л/моль. Следовательно, наличие резерва рецепторов и пороговых свойств необходимо
учитывать при определении KA.
= 0), что практически не осуществляется. Отличие от истинной величины KA
может достигать значительных величин. Так, при экспериментальном значении
[A]50= 4,4·10–7
моль/л KA= 1/[A]50 = 2,2·106
л/моль, что более чем в четыре раза меньше истинного значения константы
равновесия, рассчитанного по уравнению (21а) – 9,6·106
л/моль. Следовательно, наличие резерва рецепторов и пороговых свойств необходимо
учитывать при определении KA.
Пороговая модель
или закон “все или ничего”
Пороговая модель получается
при равенстве пороговой и максимальной концентраций рецептора, из которого
следуют три других:
[AR]min = [AR]max
——> 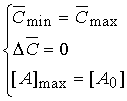 (22)
(22)
Применяя к (22) уравнения
связи (7), получаем уравнения пороговой модели:
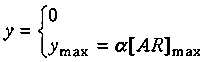 при
при 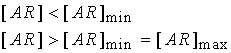 , ,
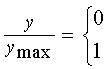 при
при 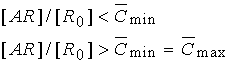 ,
(23) ,
(23)
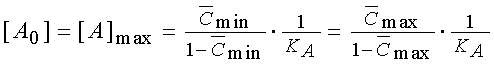 . .
Из графика уравнения (23)
следует, что по достижении пороговой концентрации агониста эффект сразу
возрастает до максимального значения (рис.
6B). В точках [AR]min
= [AR]max и
[A0] = [A]max
функция разрывна. В относительных координатах она приобретает всего лишь
два значения: 0 или 1 (рис.
6A).
В физиологии пороговые закономерности
известны как закон “все или ничего”. Ему подчиняются спонтанные сокращения
сердечной мышцы, для анализа которых нами применялось уравнение (23) [7].
Особое значение этот закон имеет при функционировании нервной системы:
передачи нервного импульса между нейронами, осуществляемое с помощью нейротрансмиттеров
(в частности, ацетилхолина), взаимодействующих с рецепторами постсинаптических
мембран. Функционирование нейронов в режиме “все или ничего”
(0 – 1) обеспечивает работу нейронных сетей [19,20]. Режим, близкий к пороговому,
найден нами при моделировании процессов клеточного деления и действия некоторых
цитостатиков [11].
Таким образом, параметры
уравнений связи: максимальная и минимальная концентрации рецепторов, а
также резерв рецепторов, определяют общий характер кривых “доза-эффект”
для агонистов и их частные случаи, что можно обобщить в следующем виде.
1.Общий случай (уравнения
15,16):
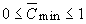 ;
0 Ј ;
0 Ј 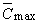 Ј
1 ; 0
Ј Ј
1 ; 0
Ј 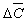 Ј
1 ; 0
Ј Ј
1 ; 0
Ј 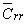 Ј
1 . Ј
1 .
2. Постулат Кларка:
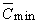 =
0; =
0; 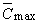 = 1; = 1; 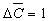 ; ; 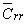 =
0. =
0.
3. Пороговая модель (закон
“все или ничего”):
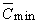 = = 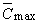 ; ; 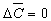 ; ; 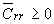 . .
Литература
-
Clark A.J. The reaction between acetylcholine and atropine
// J. Physiol. (London). 1926. Vol. 61. P. 530–546.
-
Stephenson R.P. A modification of receptor theory // Br.
J. Pharmacol. 1956. Vol. 11. P. 379–393.
-
Ariense E.J. (Ed.). Molecular pharmacology: the mode of action
of biologically active compounds. Vol. 1, N.Y.–L., 1964. 503 p.
-
Ariense E.J. Intrinsic activity:
partial agonists and partial antagonists // J. Cardiov. Pharmacol. 1983.
Vol. 5. Suppl. № 1. P. 8–15.
-
Михельсон М.Я., Зеймаль Э.В.
Ацетилхолин. О молекулярном механизме действия. Л.: Наука, 1970. 279с.
-
Зеймаль Э.В., Шелковников С.А.
Мускариновые холинорецепторы. Л.: Наука, 1989. 288с.
-
Полтораков А.П., Бут П.Г., Пирузян
Л.А., Чибрикин В.М., Вихляев Ю.И. и Ульянова О.В. Кинетика процессов взаимодействия
производных фенотиазина с биорецепторами // Изв. АН СССР. Сер.хим. 1973.
№ 9, с. 2099–2105.
-
Полтораков А.П., Чибрикин В.М.,
Пирузян Л.А. Кинетические модели одиночного мышечного сокращения // Биофизика.
1978. Т. 23. № 1, с. 105–109.
-
Полтораков А.П., Чибрикин В.М.
Кинетические модели тетанических сокращений мышцы // Биофизика. 1982. Т.
27. № 1, с. 341.
-
Полтораков А.П. Математическая
модель для описания кривых выживания организмов // Ж. общ. биол. 1996.
Т. 57. № 2, с.149–164.
-
Полтораков А.П., Коваленко О.А.,
Тарасова Н.И. Количественное описание цитостатических эффектов хелаторов
ионов переходных металлов (на примере пиколиновой кислоты и Fe2+)
// Изв. РАН. Сер. биол. № 6, с.645–652.
-
Сергеев П.В., Шимановский Н.Л.
Рецепторы физиологически активных веществ. М.: Медицина, 1987. 400с.
-
Скок В.И., Селянко А.А., Деркач
В.А. Нейрональные холинорецепторы. М.: Наука, 1987. 343с.
-
Говырин В.А., Жоров Б.С. Лиганд-рецепторные
взаимодействия в молекулярной физиологии. Спб.: Наука, 1994. 240с.
-
Данилов А.Ф. Постсинаптические
миорелаксанты. Спб.: Наука, 1994. 156с.
-
Комиссаров И.В. Элементы теории
рецепторов в молекулярной фармакологии. М.: Медицина. 1969. 216с.
-
Вентцель Е.С. Теория вероятностей.
М.: Наука, 1964. 576с.
-
Блаттнер Р., Классен Х., Денерт
Х., Деринг Х. Эксперименты на изолированных препаратах гладких мышц. М.:
Мир., 1983. 200с.
-
Черныш В.И., Напалков А.В. Математический
аппарат биологической кибернетики. М.: Медицина, 1964. 374с.
-
Еськов В.М. Введение в компартменную
теорию респираторных нейронных сетей. М.: Наука, 1994. 167с.
-
Gill E.W., Rang H.P. An alkylating derivative of benzylilcholine
with specific and long-lasting parasympatholytic activity // Molec. Pharmacol.
1966. Vol. 2, N 4. P. 284–297.
-
Chavkin C., Goldstein A. Reduction in opiate receptor reserve
in morphine tolerant guinea pig ilea // Life Sci., 1982. Vol. 32, N 16–17.
P. 1687–1690.
-
Schulman J.M., Sabio M.L. and Disch R.L. Recognation of cholinergic
agonists by muscarinic receptors. 1. Acetylcholine and other agonists with
NCCOCC backbone // J. Med. Chem. 1983. Vol. 26. N 6. P. 817–823.
Copyright ©
|


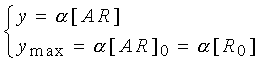 при
при 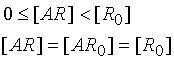 ,
(1)
,
(1)
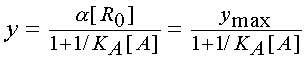 .
(2)
.
(2)
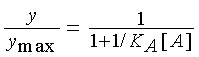 .
(4)
.
(4)
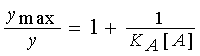 ,
(4a)
,
(4a)
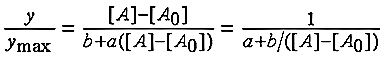 ;
; 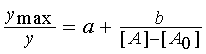 ,
(5,6)
,
(5,6)
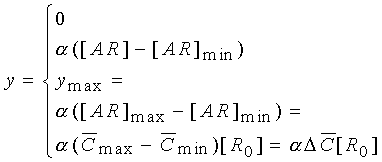 при
при 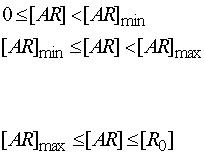 ,
(7)
,
(7)
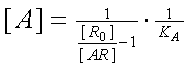
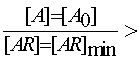
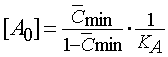 .
(12,13)
.
(12,13)
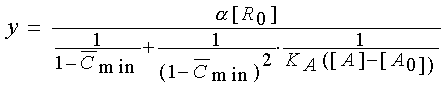 .
(14)
.
(14)
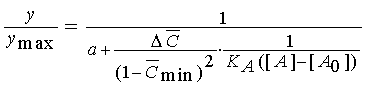 ,
(15)
,
(15)
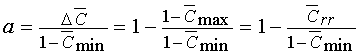 .
.
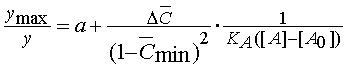 .
(16)
.
(16)
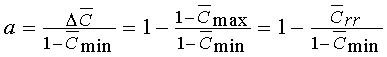 ;
; 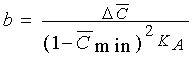 ;
(17)
;
(17)
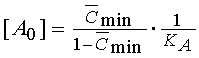 ,
, 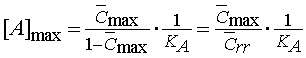 .
.
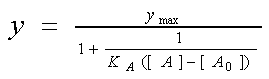 .
(19)
.
(19)
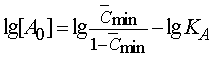 ;
; 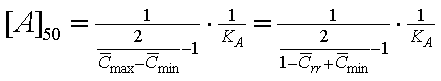 .
(21)
.
(21)
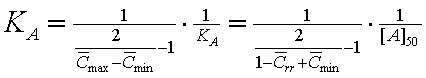 .
(21а)
.
(21а)
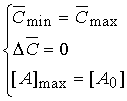 (22)
(22)
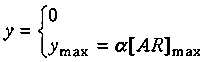 при
при 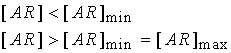 ,
,
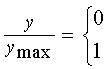 при
при 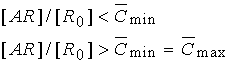 ,
(23)
,
(23)
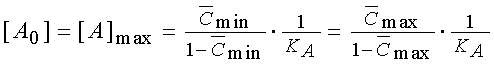 .
.