|
[ На предыдущий раздел]
Анализ сорбции, растворимости и взаимодействия аммиака, сернистого ангидрида, оксидов азота с полимерами представляет интерес по нескольким причинам. Во-первых, она имеет решающее значение при разработке процессов селективного разделения газов на мембранах в технологических циклах [1, 2], поскольку селективность газоразделения определяется селективностью диффузии и селективностью растворимости пенетрантов. Во-вторых, эта проблема тесно связана с решением проблем экологии окружающей среды, а именно, с эффективным удалением этих газов с помощью полимерных сорбентов из воздуха промышленных зон. Наконец, с точки зрения теории растворов полимеров изучение термодинамических свойств таких систем представляет значительный интерес, поскольку они относятся к немногочисленным полимерных системам с ярко выраженным специфическим взаимодействием компонентов [2, 3].
Как показано в [4], располагая информацией об изотермах сорбции газов на полимерных мембранах либо на полимерах, которые предполагается использовать в качестве мембран, можно:
– определить коэффициенты растворимости, которые закладываются в расчет селективности мембран;
– выявить наиболее эффективные сорбенты и оптимизировать условия поглощения;
– рассчитать термодинамические потенциалы, их концентрационные и температурные зависимости и таким образом оценить механизм их взаимодействия с функциональным группами мономерных звеньев полимеров.
В последние годы, по указанным причинам, уделяется достаточно большое внимание экспериментальному анализу систем газы (пары) – полимерные адсорбенты, которые подробно описаны, в частности, в монографиях [3–5]. Для прогнозирования этого взаимодействия в работах [1, 2] использован квантовомеханический подход. В работах [6, 7] развивается концепция квазихимического подхода. Наряду с этим в практике физико-химических исследований полимеров широкое распространение нашел метод групповых вкладов, описанный в работах Ван Кревелена [8].
Целью данной работы явилась попытка использовать и развить этот подход применительно к системам полимер – диоксид серы ( SO2).
Напомним, что при описании систем полимер – вода [8] используют принятый в теории растворов термин – гидратное число функциональной группы мономерного звена макромолекулярной цепи ( табл. 1). Согласно определению, оно несет информацию о числе молекул воды, сорбируемых на этих группах при заданной температуре и относительном давлении пара. В теории групповых вкладов априори предполагается, что сорбционная емкость всего мономерного звена является простой аддитивной величиной гидратных чисел функциональных групп и что гидратное число функциональной группы постоянно и не зависит от состава и строения макромолекулярной цепи.
На данном этапе исследований при анализе систем полимер – SO2 мы воспользовались теми же исходными положениями теории групповых вкладов, лишь заменив термин “гидратное число” на термин “сульфитное число”. Таким образом, проблема определения изотерм сорбции SO2 полимерами свелась к эмпирическому расчету сульфитных чисел различных функциональных групп полимерных цепей.
На рис. 1, 2 представлены типичные изотермы сорбции SO2 – эластомерами, пластиками, стеклообразными полимерами, заимствованные нами из литературы [1, 2, 5] и полученные экспериментально на автоматических вакуумных весах ИФХАН. В качестве сорбентов использовали пленки промышленных эластомеров – натуральный каучук, полиизопрен (СКИ-3), полиизобутилен (БК), полихлоропрен (Неопрен G), бутадиен-стирольный сополимер (СКС-30), бутадиен-акрилонитрильный сополимер (СКН 26 и СКН 40), этилен-пропиленовый сополимер (СКЭПТ-50), – толщиной 100–150 мкм, полученные методом прессования.
Можно видеть, что сорбционная емкость полимеров по отношению к SO2 закономерно изменяется с изменением состава мономерных звеньев и содержания в них функциональных групп. Так, для полиолефинов, в состав мономерных звеньев которых входят –СН2–, –СН3,  , сорбционная емкость по SO2, рассчитанная на аморфную фазу сорбента, минимальна. Введение в состав мономерного звена двойных связей, как при переходе от полиэтилена к полибутадиену или полиизопрену, приводит к увеличению сорбционной емкости полимера. Аналогичный эффект наблюдается, если в состав цепи входит фенильный радикал, галогены, нитрильная группа и т.д. Следует отметить, что в той же последовательности изменяются и коэффициенты растворимости SO2, измеренные методами проницаемости [1, 5]. , сорбционная емкость по SO2, рассчитанная на аморфную фазу сорбента, минимальна. Введение в состав мономерного звена двойных связей, как при переходе от полиэтилена к полибутадиену или полиизопрену, приводит к увеличению сорбционной емкости полимера. Аналогичный эффект наблюдается, если в состав цепи входит фенильный радикал, галогены, нитрильная группа и т.д. Следует отметить, что в той же последовательности изменяются и коэффициенты растворимости SO2, измеренные методами проницаемости [1, 5].
Существенно, что для эластомеров изотермы сорбции SO2 так же, как для воды и газов [3–5], имеют вид вогнутых к оси абсцисс кривых (IV тип изотерм сорбции по классификации Роджерса [9]), тогда как для жесткоцепных стеклообразных полимеров – S-образный вид (III тип). Как показано в [4], S-образность изотерм связана с наличием в таком полимерном сорбенте значительного избыточного свободного объема, в котором функциональные группы полимера оказываются свободными к взаимодействию с молекулами сорбата. Поскольку этот участок изотерм несет информацию о неравновесном состоянии полимерного сорбента, он был исключен из расчетов. Способ такого “исключения” описан в [10, 11].
Расчет сульфитных чисел, которые по сути дела характеризуют количество молекул SO2 на моль соответствующей группы мономерного звена, проводился по следующему алгоритму:
1. Для простейших полимерных сорбентов, мономерные звенья которых состоят только из групп –СН 2– (ПЭ), –СН2–,  и –СН3 (ПП, БК, СКЭПТ), рассчитывалось сульфитное число на моль этих групп. Расчеты проводились только для сорбции SO2 аморфной фазой полимеров, предполагая одновременно полную (100%) доступность этих групп к взаимодействию с растворенными молекулами сорбата. и –СН3 (ПП, БК, СКЭПТ), рассчитывалось сульфитное число на моль этих групп. Расчеты проводились только для сорбции SO2 аморфной фазой полимеров, предполагая одновременно полную (100%) доступность этих групп к взаимодействию с растворенными молекулами сорбата.
2. На основании этой информации и изотерм сорбции более сложных по молекулярной структуре полимеров, например, полибутадиена и полиизопрена, рассчитывалось сульфитное число для двойной связи за вычетом числа молей SO2, приходящихся на группы –СН2– и –СН3, найденных ранее.
3. На последующих этапах расчетов выбирались полимеры, структура мономерных звеньев которых позволяла получать информацию о других функциональных группах – фенильном радикале (СКС), группе – CN (СКН), –Cl (ПХП) и т.д. При этом предпочтение первоначально отдавалось эластомерам, а затем к расчетам привлекались стеклообразные полимеры – полистирол, полиакрилонитрил, поливинилхлорид, поливинилацетат и т.д.
Результаты расчетов сульфитных чисел (средние, с доверительным интервалом 0,93) для различных значений относительного давления паров SO2 приведены в табл. 2. Можно видеть, что наибольшие значения сульфитные числа имеют для азотсодержащих групп –С=N– (от 0,128 до 3,0) и для сложноэфирной группы (от 0,186 до 1,382), а наименьшие – для неполярных  и –СН2– групп (от 1,56∙10–3 до 11,9∙10–3). Все остальные занимают промежуточное положение. и –СН2– групп (от 1,56∙10–3 до 11,9∙10–3). Все остальные занимают промежуточное положение.
С целью установления общего и специфического в поведении различных полярных сорбатов нами было проведено сравнение полученных данных с величинами мольного содержания воды в полимерах на одну полярную группу ( табл. 1). Можно видеть, что величины, приведенные в табл. 1 и 2, близки. При этом наибольшие значения мольного содержания воды наблюдаются для карбоксильной, карбонильной, уретановой и аминогрупп, наименьшие значения мольного содержания воды – для тех же групп  , –СН2–, –СН3 (1,5∙10–5 – 5∙10–5) и т.п. , –СН2–, –СН3 (1,5∙10–5 – 5∙10–5) и т.п.
На основании этих данных нами построена корреляционная зависимость между гидратными и сульфитными числами функциональных групп мономерных звеньев полимеров ( рис. 3). Можно видеть, что имеет место четко выраженная тенденция возрастания как гидратных, так и сульфитных чисел при изменении полярности функциональных групп полимеров. Эта тенденция сохраняется при различных относительных давлениях паров сорбатов. В первом приближении можно говорить о линейной корреляционной зависимости вида
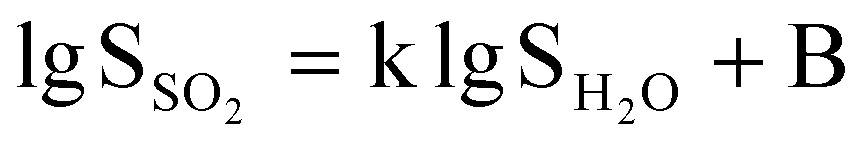 . .
Отклонение от приведенной зависимости наблюдается главным образом для арильного радикала, представляющего боковую группу карбоцепных полимеров.
Использованный в работе [12] локальный параметр растворимости функциональных групп оказался плодотворным и при анализе результатов, полученных в данной работе. Как можно видеть из рис. 4, с увеличением параметра растворимости полимеров, который изменяется пропорционально изменению полярности функциональных групп, растворимость воды в полимерах непрерывно увеличивается, достигая максимального значения для полимеров, в состав мономерных звеньев которых входят гидроксильные группы. Аналогичная тенденция наблюдается для SO2, однако, в результате получается кривая, по форме напоминающая гауссову. Максимальное значение этой кривой (отмечено стрелкой), при которой растворимость достигает максимального значения, соответствует параметру растворимости SO2, который по оценкам составляет 10,4 (кал/см3)1/2.
Отметим, что наибольшее отклонение вновь приходится на арильный радикал. Можно предположить, что в арильной боковой группе существуют небольшие положительные заряды в мета-положении, которые по распределению зарядов и стерическим факторам склонны к образованию донорно-акцепторного взаимодействия с атомами кислорода, имеющими отрицательный заряд в диоксиде серы [13].
Таким образом, на основании полученных нами сульфитных чисел, открывается возможность априорного расчета изотерм сорбции, а, следовательно, и коэффициентов растворимости SO2 полимерами по известному или заданному строению мономерного звена, составу макромолекулярной цепи, фазовому состоянию мембраны.
[ На Список литературы]
Copyright ©
|

