| На главную страницу журнала | На первую страницу сайта |
Профессор С.Д. Варфоломеев,
заведующий кафедрой химической энзимологии
Химического факультета МГУ,
отвечает на вопросы обозревателя
"Химии и жизни" М.Литвинова
Одна из главных задач химиков – научиться ускорять химические реакции с помощью катализаторов, чтобы быстрее производить нужные вещества (материалы, препараты) и уничтожать ненужные (например, токсичные отходы). В природе эта задача давно решена. Появление органических катализаторов – ферментов – стало одной из поворотных точек в развитии жизни на Земле. Ферменты намного эффективнее химических катализаторов, а кроме того, более избирательны: могут извлекать из сложной смеси только одно вещество и превращать его не в несколько продуктов, а в один. Неудивительно, что химики и физики давно уже пытаются понять, как устроены и работают ферменты. Энзимология интересует и биологов. Они тоже хотели бы знать, как работают ферменты, как эти молекулы усложнялись и совершенствовались и что это давало живым организмам. Ферменты – природные нанороботы, главные рабочие инструменты всего живого. Они отвечают почти за все химические реакции, проходящие в живом существе: обеспечивают энергией и строительными материалами; создают и разрушают сигнальные молекулы, нужные для регуляции жизненных процессов; защищают организм от чужеродных веществ. Еще ферменты перезаписывают и размножают наследственную информацию, то есть синтезируют ДНК и РНК. Наконец, участвуют в реализации этой информации – в синтезе самих себя и других белков.
– Ферментативный катализ был открыт в 1814 году, однако о том, как работают ферменты и почему они ускоряют реакции, даже в середине нашего века ничего не было известно. В ка кой момент произошел перелом, когда стало ясно что по край ней мере для одного фермента механизм действия разгадан?
– Назвать первый фермент трудно, наверное, даже невозможно. Механизм расшифровали почти одновременно для нескольких ферментов. Среди первых были сериновые протеазы, которые расщепляют белки (сериновыми они называются потому, что в реакции участвует аминокислота серин, а протеазами потому, что их субстрат – белки, или протеины). В 1968 году Блоу с сотрудниками опубликовал трехмерную структуру одной из таких протеаз. химотрипсина, – это был решающий момент в их исследовании. В то же время другие группы ученых работали с другими ферментами. В России, например, много занимались аспартатаминотрансферазами. Установили структуру, изучили кинетику и тоже во всем разобрались.
Так что дело здесь не в первом ферменте, а в том, что сразу появилось много понятий и все стало на свои места. Перелом произошел в 60 – 70-е годы.
– Кстати, обьясните, пожалуйста, что понимают под механизмом действия фермента? Как его описывают, в каких терминах, формулах?
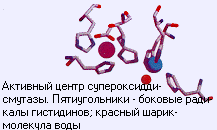
– Под механизмом действия фермента понимают последовательность превращений молекул в его активном центре. Акт катализа начинается со связывания субстрата, затем происходит с десяток изменений, и, наконец, появляется продукт. Вот эту последовательность химических операций и понимают под механизмом. Механизм – это понятие, заимствованное из химической кинетики. Оно отражает сложность процесса. То есть нет такого, что сразу тысяча атомов сместилась и встала в новое положение. Любая химическая реакция происходит на отдельных связях между атомами, и поэтому большие перемещения, большие изменения – это просто последовательность большого числа стадий, которую можно записать химически. Можно выразить и в физических терминах как изменение потенциальной энергии компонентов, можно записать в биологических терминах: одно вещество превращается в другое. В любом случае понятие механизма включает информацию о промежуточных соединениях.
В ферментах нет ничего, что не было бы известно в элементарной химии, за исключением одного – организации процесса. Ферментативные реакции отличаются от обычных химических только тем, что ферментативный процесс – это хорошо организованная последовательность элементарных актов. Смещение протона на полтора ангстрема повышает реакционную способность в десять миллионов раз. Вот вы берете воду, у нее каталитическая константа для какой- то реакции равна единице. Берете гидроксильный ион, у него скорость на 7 порядков выше, то есть он ускоряет эту же реакцию в 107 раз. Берете протон – это еще в 107 раз быстрее. А что делает фермент? Он делает очень простую вещь: берет этот протон и вытягивает его на себя с помощью отрицательно заряженной карбоксильной группы. Все это происходит в плотной упаковке активного центра. Вода, инертное соединение, превращается в гидроксильную группу с высокой реакционной способностью.

– 20 лет назад механизм действия был известен лишь для нескольких ферментов. Что, на ваш взгляд, изменилось с тех пор?
– У меня такое ощущение, что сейчас основную информацию о механизме ферментативного катализа мировая наука уже получила. Идет добавление новых структур, но ничего принципиально нового не появляется.
Нам понятно, как ферменты работают, где и какие у них должны быть реакционные группы, как они атакуют субстрат, как перемещаются электроны.
Можно даже сказать, что ферменты – самые понятные катализаторы. Мы знаем о них намного больше, чем, например, о неорганических катализаторах.
– Не расскажете ли вы о том, насколько разнообразны или, наоборот, похожи ферменты?
– В базах данных собрано 3709 фер ментов (по числу известных катали зируемых реакций), они разделены на шесть классов. Открытия новых практически прекратились. Однако типов активных центров намного меньше. Часто в реакциях субстратов из разных классов участвуют одни и те же группы. Например, из более чем трех тысяч известных ферментов почти 1100 – гидролазы. У них всего 5 типов активных центров. Их химическая природа различна. Какие-то зависят от ионов магния, какие-то нет. Каждая из этих гидролаз представлена тысячами последовательностей. А в главном все они похожи.
Можно сказать, если природа на ходила хорошее решение, хорошую конфигурацию, она сохраняла ее. Самое удивительное, что группы, входящие в активный центр, у разных ферментов могут находиться в разных местах в цепочке аминокислот, но, когда эта цепочка складывается, они сближаются, и трехмерная структура активного центра у них получается одинаковая.
Так что если найдена наиболее эффективная конфигурация, она используется в разных белках. Приведу такой характерный пример. Ферменты, гидролизующие ДНК (экзонуклеазы, эндонуклеазы), активируют воду с помощью комплекса ионов магния с карбокоильными группами и присоединяют ее к ДНК, которая при этом рвется. Что делает ДНК-полимераза? Она сшивает два основания, точнее, два сахара через фосфаты. Тот же самый активный центр, но активирует не воду, а гидроксильную группу сахара. И вместо того, чтобы пошел гидролиз, эта гидроксильная группа повышает реакционную способность и сшивает сахара через фосфат, и в таких реакциях образуется ДНК.
– Чем же тогда различаются ферменты?
– У них разные участки связывания суботратов, и это понятно: в клетке много разных веществ и нужно добитьой комплементарности структур, чтобы каждый фермент мог выловить из раствора свой субстрат. Если взять тот же пример, эндонуклеазу и ДНК полимеразу, у них по-разному устроены центры сорбции, или связывания.
– У разных организмов ферменты, катализирующие одни и те же реакции, могут сильно различаться. Можно ли представить, как происходила эволюция фермнентов? – Вероятно, через мутации, делеции (удаления), вставки и прочие перестройки ДНК. Конфигурация активного центра сохранялась и использовалась в разных белках, при этом почти все аминокислоты, кроме нескольких, могли меняться.
Гомология между двумя сходными по функции ферментами может быть очень большой, или ее может почти не быть. Степень гомологии, кстати, можно рассчитать с помощью специальных программ, а численно ее выражает функция Шеннона Н = -Рi log2 Рi, где Рi – вероятность нахождения данной аминокислоты в полипептидной цепи, а Н отражает степень гомологии.
– Скажите, пожалуйста, сильно ли сказываются различия между фермента ми на скорости их работы? Приводила ли эволюция к большей скорости?
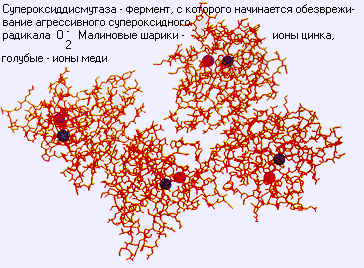
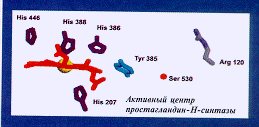
– Разброс скоростей очень невелик: для большинства ферментов число оборотов, то есть число актов катализа в секунду, равно 100, для самых быстрых (каталазы, карбоангидразы, супероксиддисмутазы) – 104. Среди самых медленных ферментов – простагландинсинтаза (число оборотов – 1). Как правило, скорость лимитируется диффузией субстрата или переносом протона на воду – это фундаментальное физическое ограничение, которое невозможно преодолеть. А сам акт катализа происходит очень быстро.

– Зачем же тогда все остальное, что не входит в активный центр и участки связывания?
– Во-первых, цепочка аминокислот должна иметь возможность изогнуться, чтобы реакционные группы сблизились, – для этого она должна быть достаточно длинной. Кроме того, некоторые части фермента нужны для регуляции: для связывания с другими белками, с кофакторами. Это очень тонкие вещи.
– Почему фермент не может быть слишком большим? Что ограничивает его размеры сверху?
– Слишком большой белок будет легко денатурировать. Если какие-то петли высунутся из глобулы (а это то и дело происходит благодаря тепловому движению), его переварят специальные клеточные протеазы.
– Я понял из ваших слов, что сейчас более или менее ясно, как устроены и работают если не целые ферменты, то, по крайней мере, их активные центры. Обычно такие знания стараются использовать в практике. Пытался ли кто- нибудь повторить действие ферментов более простыми молекулами или их ансамблями?
– Здесь наблюдается большой прогресс, а сама эта область называется биомиметика – имитирование биологических систем на молекулярном уровне. В катализе очень много сделано, придумано много моделей. Катализ един, и есть много общего между гомогенным катализом, катализом полимерами, ферментативным катализом, поэтому моделирование ферментов – это хороший метод. Но мне кажется, что биомиметические аналоги имеет смысл делать только для таких условий, когда ферменты не работают: при температуре выше 100o , в газовой фазе и так далее.
– Наверное, и в органических растворителях?
– В органических растворителях ферменты давно работают. А вот при нормальных условиях реакция зачастую термодинамически невозможна. Например, крекинг нефти. Там связь при нормальной температуре не разорвется, это следует из термодинамики. Тогда нужно создавать катализаторы на тех же принципах, что и ферменты.
– По идее, логика создания биомиметических катализаторов должна повторять логику фермента. Если сравнить фермент со станком, то он должен закрепить детали, подвести к ним какой-то рабочий инструмент и что-то удалить или приделать.
– Примерно так и делают, хотя не настолько прямолинейно. Организуют структуры, необходимые для того, чтобы субстрат связывался и ориентировался; подводят нуклеофильные и электрофильные группы...
– Как же можно их закрепить, расположить в пространстве, ориентировать?
– Для этого есть целая область – супрамолекулярная химия, которая позволяет учесть межмолекулярные взаимодействия. Активные группы располагают на матрице, не обяза тельно полимерной. Это может быть и углеродный скелет. Вот это и есть биомиметика – моделирование химического катализатора на биологических принципах. Она хорошо работает тогда, когда не конкурирует с ферментами.
– Вы уже сказали, что модели работают тогда, когда ферменты неактивны. Наверное, их можно использовать и для превращения молекул, не существующих в природе?
– Парадокс заключается в том, что ферменты перерабатывают любые вещества. Где вы видели зарин или заман в природе? Пока человек не создал эти вещества, их не было. А ферменты, которые расщепляют связь Р – F , есть. Сейчас возникли технологии для уничтожения химического оружия. Микробные ферменты могут разрушить любую связь и таким образом преобразовать любое вещество.
– Даже диоксины?
– Даже диоксины.
– Выходит, ферменты могут разрушить любое вещество. Однако ломать – не строить. Можно ли создавать нужные вещества с помощью ферментов?
– Может быть, не любые, но, во вся ком
случае, ферменты активно используют для тонкого
химического синтеза, то есть для синтеза сложных
органических молекул.
Возьмем производство пенициллина. Сначала с
помощью ферментов гидролизуют бензилпенициллин
и получают 6-аминопенициллановую кислоту.
Неферментативный, кислотный катализ для этого не
годится – разрушится совсем другая связь. Потом
с помощью ферментов получают химические
модификации, например вместо бензильной группы
вставляют какую-нибудь фенилуксусную или
что-нибудь еще. С помощью ферментов получается
совсем другое вещество, то есть они проводят
синтез. Ферменты, которые проводят такие реакции,
сначала находят в природе, а затем их усиливают,
улучшают методами отбора, генетической
модификации. Фармацевтическая промышленность
сейчас очень активно использует ферменты для
тонкого химического синтеза.
– Скажите, пожалуйста, а быстро ли развивается промышленность, использующая ферменты?
– Прирост производства выделенных, очищенных ферментов для технических целей в мире составляет 15% в год, а химических катализаторов – 3% в год.
Расчеты показывают, что в 2010 году их
производство сравняется. Это только в
промышленности, однако у ферментов область
применения гораздо шире. Это и медицина, и
сельское хозяйство, и защита окружающей среды
(аналитические измерения, или мониторинг;
разрушение загрязнений, или биоремедиация). Это
пищевая промышленность, производство лекарств,
средств защиты растений, химических реагентов.
Приведу примеры. Сейчас стиральный порошок без
ферментов – это что-то устаревшее. В лучшие
порошки обязательно добавляют протеазы, липазы
и так далее.
Или еще: вся Америка ест сахар, ферментативно
полученный из кукурузного крахмала.
Кроме того, есть области, где ферменты ничем нельзя заменить. Например, анализ. Сейчас сотни ферментов используют в аналитических целях, часто они наиболее пригодны.
Вот еще классический пример – разделение правых и левых оптических изомеров, например D- и L-аминокислот. В химических реакциях получаются их смеси, а нужен обычно только один изомер. Берут ферменты, которые или удаляют один изомер из смеси, или, наоборот, производят только его.
|
|
– Применяют ли ферменты для производcтва биоcенcоров?
– Да, конечно. Например, для определения глюкозы в крови. Сенсор построен на основе глюкозооксидазы. Он очень нужен больным диабетом, ведь не могут же они каждые два часа ходить в клинику, чтобы сделать анализ. Есть портативные приборы, которые сразу выдают концентрацию.
– А как изучают новые ферменты?
– Здесь уже есть некие стандарты. Во-первых, методы выделения. Сейчас даже студент может выделить почти любой белок; для этого достаточно пропустить раствор с ним через три-четыре колонки. Кроме того, три четверти выделяемых белков получают генно-инженерными методами. Есть способ извлечь из клеточного экстракта какой угодно белок. В ген этого белка вставляют определенную последовательность нуклеотидов, и в белке появляется известный фрагмент. Затем экстракт пропускают через колонку, где сорбент специфически связывается с этим фрагментом. Таким образом чистый белок получают всего в одну стадию. В общем, методы выделения стали стандартными.
Чтобы понять, как работает фермент, нужно знать его структуру и кинетику. И то и другое тоже узнают традиционными методами, и очень быстро. Структура – это в первую очередь сиквенс, последовательность аминокислот. Она содержит огромную информацию. Трехмерную структуру дает рентгеноструктурный анализ, полностью автоматизированный. После того как вы приготовили кристалл, вам нужно поехать в Германию, и там вам за две-три недели все сделают. Чтобы получить кристалл, нужно наработать около 5 миллиграмм белка, а генно-инженерные методы дают десятки грамм в литре. Кинетические исследования позволяют выделить и детально проанализировать все стадии каталитического акта.
- Я слышал, есть очень мощный метод –ядерно-магнитный резонанс. Используют ли его для исследования белков?
-Обязательно. Если белки маленькие, все стремятся делать ЯМР. Этот метод позволяет в динамике посмотреть, как изменяется конформация белка, то есть как изгибаются и перемещаются цепи. При этом можно варьировать внешние условия в растворе, можно свернуть белок или развернуть его. Это уже стало такой банальностью... Студенты применяют их, даже не за- думываясь, как вы об электронных переходах в калькуляторе. С помощью компьютера в геноме ищут гены (а значит, и белки), гомологичные известным генам, ищут гомологии между известными белками, пытаются определить трехмерную структуру белка по его последовательности аминокислот. Все эти задачи решает новая крупная область биоинформатика. Есть еще одна проблема, за которую кто-то охотно берется, а кто-то сразу от нее отмахивается, это проблема происхождения ферментов и жизни вообще. Я боюсь, что это не экспериментальная задача и не теоретическая. Теория показывает, что, по статистике, при нормальном развитии за три миллиарда лет эти структуры перебором получиться не могут. Возможно, произошла более глубокая эволюция. Может быть, что-то было занесено на Землю из Космоса, либо случился некий акт, который не определяется статистикой, выходит за рамки вероятности. А раз так, значит, либо кто-то придумал, либо случилось нечто, чего обычными статистическими расчетами ни подтвердить, ни опровергнуть нельзя.
Мы исходим из того, что жизнь уже есть.
Ее можно модифицировать, как мы пытаемся, но
создать четыре основания ДНК, двадцать
аминокислот, все подогнать... Тут что-то нечисто.
На мой взгляд, бессмысленно заниматься этой
проблемой, потому что ее нельзя ни доказать, ни
опровергнуть - это символ веры.