Рис. 1a |
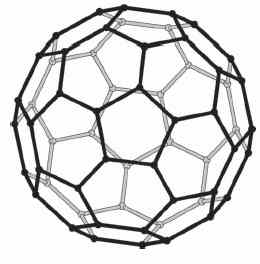
Рис. 1b |
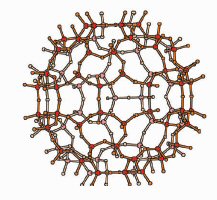
Рис. 2a |
Рис. 2b |
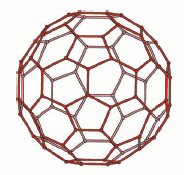
Рис. 2c |
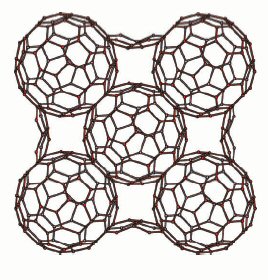
Рис. 3 |
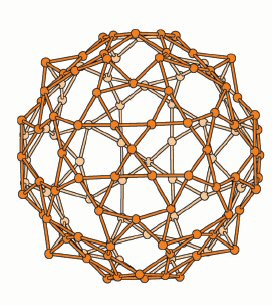
Рис. 5a |
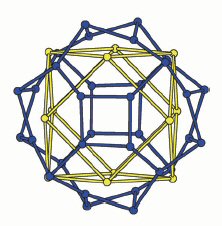
Рис. 5b |
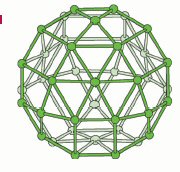
Рис. 5c |

Рис. 5d |
Рис. 5e |

Рис. 6a |
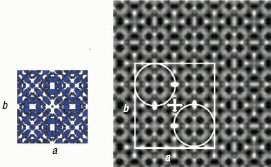
Рис. 6b |

Рис. 6c |
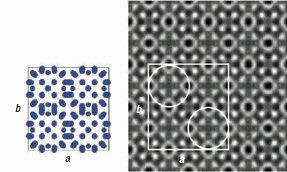
Рис. 6d |
|
Дорога к фуллереноидным оксидам
Maryvonne Hervieu, Benjamin Mellene, Richard Retoux, Sophie Boudin and Bernard Raveau
Тетраэдрические оксиды, такие как силикаты и алюминаты,привлекли к себе пристальное внимание
благодаря потенциальной возможности их применения в различных областях ‑
от катализа до термо- и фотолюминесценции. Несмотря на их тетраэдрическую
природу, до сих пор не было попыток установить структурное соответствие между
этими оксидами и различными формами углерода, например, фуллеренами. Maryvonne Hervieu с соавторами (Лаборатория
CRISMAT, Франция) в апрельском номере журнала “Nature Materials” впервые представили оксиды,
обладающие трехмерной структурой AlO4-тетраэдров,
образующих гигантские “Al84”-сферы, подобные сферам D2d изомера
фуллеренов C84. Эти “Al84”- сферы, располагающиеся в
узлах гранецентрированной кубической решетки, легко идентифицируются с помощью
электронного микроскопа с высоким разрешением. Авторы работы также показали,
что алюминат Sr33Bi24+δAl48O141+3 δ/2
имеет субнаноструктуру, подобную луковой кожуре, образуемую частицами Bi/Sr/O,
локализованными внутри Al84 -сфер. Авторы обсудили роль
псевдо-сферического аниона [Bi16O52-n□n] в стабилизации
такой структуры. Эта структура, по мнению авторов, открывает новый большой
класс фуллереноподобных оксидов (фуллереноидов) с различными свойствами.
Тетраэдрические оксиды, включающие такие элементы, как Si и Al, привлекли к
себе внимание благодаря их потенциальной возможности широкого применения.
Недавно были исследованы стронций-алюминаты как пигменты для фотолюминесценции
или термолюминесценции [1], а ионно-обменные, адсорбционные и каталитические
свойства силикатов и силикоалюминатов из семейства цеолитов и ультрамаринов,
также как и их поведение, как молекулярного сита, сейчас исследуются [2‑8].
Эти оксиды имеют различные сложные структуры, которые можно лучше понять, если
рассматривать их топологию следующим образом: каждый тетраэдр, обычно
образуется металлическим (M) атомом (Al или Si), образуемые большие
полости и туннели легко идентифицируются в трехмерных (3D) структурах,
атомы Al или Si связаны прямыми линиями [см, например 11, 12].
Принимая во внимание эту модель, интересно сравнить M= Si, Al–структуры цеолитов
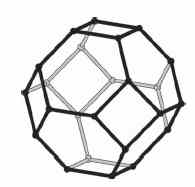
со структурой фуллеренов. Это иллюстрируется, например, для Na8-10Al6Si6O24Si2-4
(Рис. 1), построенного из шестиугольных (Al, Si)6 и квадратных (Al,
Si)4 "окон". Это соединение можно сравнить с фуллереном C60
(Рис. 1b), который состоит из сферических молекул С60, построенных
из пятиугольников С5 и шестиугольников С6. Этот
топологический анализ показывает возможность синтеза фуллереноидных оксидов, в
которых металлические атомы могли бы образовывать, по аналогии с фуллеренами,
"бакиболлы", сцепление между которыми обеспечивалось бы атомами
кислорода, расположенными посередине между двумя металлическими атомами, каждый
из которых находится в узлах тетраэдра.
В данной статье представлен первый фуллереноидный оксид, который состоит из
сфер Al84, схожих со сферами изомеров фуллерена С84 [14],
и показано, что сферы Al84 образуют 3D-гранецентрированную
кубическую решетку (ГЦК).
Наша стратегия синтеза фуллереноидных оксидов базируется на том факте, что
реализация таких Mn сфер в форме 3D-тетраэдрической структуры,
требует, чтобы Mn-сферы были заполнены объемными частицами, которые
бы обеспечивали стабильность такой структуры. Каждая MnO(3n+2)/2
сфера может быть стабилизована различными органическими ионами или молекулами
методом гидротермического синтеза, ну введение в структуру гидроксильных групп
рискованно, поскольку есть вероятность уменьшения стабильности материала.
Другая возможность состоит во введении больших катионов для нейтрализации
отрицательных зарядов, образуемых MnO(3n+2)/2 -сферами. Мы выбрали
этот путь синтеза.
Анализ предыдущих исследований, выполненных на 3D-алюминатах, показывает,
что среди выделенных многочисленных соединений представляет большой интерес
алюминат Sr6Bi2O3(AlO2)12
[15], поскольку его тетрагональная структура [AlO2]∞
образует большие полости и туннели, где локализованы Sr2+ катионы и
BiO3 -группы. Основываясь на этих наблюдениях, мы обратились к
системе SrO-Bi2O3 – Al2O3. Во время
проведенных исследований, используя твердофазную реакцию, мы выделили алюминат
Sr33Bi24+δAl48O141+3 δ/2
из смеси SrO, Bi2O3, Al2O3 . Был
также выращен и исследован методом рентгеновской дифракции монокристалл этого
нового алюмината. Полученный алюминат имеет кубическую ячейку (a = 25.09
Å) и относится к пространственной группе F43m. Его кристаллическая
структура на первый взгляд кажется весьма сложной: он имеет тетраэдрическую
3D–структуру, в узлах которой находятся AlO4, образующие большие
сферические объемы, содержащие Sr2+ катионы и висмут‑кислород
кластеры. Более того, между этими объемами находятся дополнительные Sr2+
катионы.
Первая важная особенность этой структуры связана с решеткой алюминия. Атомы
алюминия образуют огромные сферы Al84 (рис. 2а), построенные из
пятиугольников Al5 и шестиугольников Al6 , подобно
фуллеренам. Фактически эта конфигурация, характеризуемая пятиугольными парами
(рис. 2б) соответствует наиболее часто встречающемуся D2d -изомеру – фуллерену
С84 [14]. Тем не менее, размер сфер Al84 намного больше,
чем для С84 фуллерена, их диаметры составляют, соответственно, 18, 5
Å и 8,5 Å. Такая большая разница в размере связана с атомами
кислорода, дислоцированными приблизительно посередине между двумя соседними
атомами алюминия, так что Al84 -сферы создают Al84O210
-сферу, состоящую из тетраэдров, в узлах которых находятся AlO4 (рис.
2с).
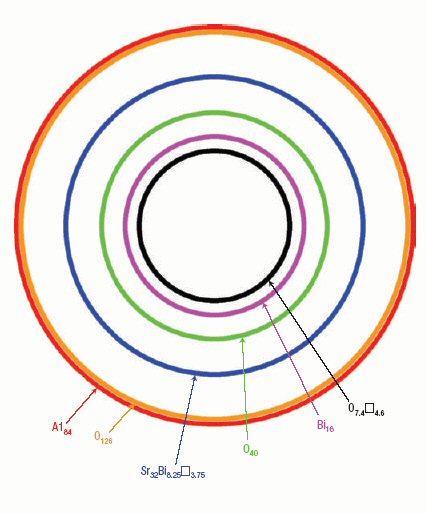
Другая важная черта касается расположения сфер Al84, которые
образуют ГЦК-структуру, как это можно видеть из проекции решетки алюминия на
направление [100] (рис. 3). Более того, каждая сфера имеет общие гексагональные
Al6 грани с 12-тью другими идентичными сферами, образующими [Al∞]
3D–структуру. В этом отношении "алюминиевая сеть" в данном алюминате
сильно отличается от фуллеренов, в которых Сn ‑сферы
изолированы. Что касается "кислородной сети", стоит отметить, что
атом кислорода на один алюминиевый атом располагается вне Al84–сферы.
Это значит, что 84 атома кислорода Al84O210 -сферы
расположены вне ее. Двенадцать из этих атомов кислорода образуют Al-O-Al
мосты между двумя сферами, формируя 3D-структуру AlO4 -тетраэдров.
Остальные 72 атома кислорода участвуют в соседних Al84–сферах.
Оставшиеся 126 атомов кислорода (3/2 атома на атом алюминия) образуют слой
внутри Al84–сферы, формируя O126-сферу.
Третье исключительное структурное свойство заключается в субнаноструктуре,
образуемой сетью "BiSrO", подобной луковой кожуре, расположенной
внутри Al84–сферы, как схематически представлено на рис. 4. O126-сферы
(рис. 5а) построены из трехгранных групп O3, образующих
шестиугольные - O6 пятиугольные - O5 окна,
подобно Al84–сферам, которые, однако, имеют общие углы, а не грани.
Внутри O126-сферы стронций и часть узлов с висмутом образуют третью
концентрическую сферу Sr32(Bi8.25□3.75) (рис.5б), которая
состоит из двух взаимопроникающих сфер: Sr32-сферы (голубого цвета),
построенной из соприкасающихся по граням Sr4 и Sr6-
колец, и частично заполненной Bi8.25□3.75–сферы
(желтого цвета), построенной из квадратов -Bi4 и треугольников -Bi3
. Четвертая O40 -сфера (рис. 5с) состоит из треугольников O3 и
квадратов O4. Пятая сфера представлена центральной группой Bi16
(рис. 5d), образующей соприкасающиеся Bi3-треугольники с расстоянием
Bi‑Bi, меняющимся от 3.54 до 4.21 Å. Наконец, внутри последней
сферы находится усеченный тетраэдр O12 (рис. 5е),
заполненный лишь на 61,5%.
Эта очаровательное структурное своеобразие ясно иллюстрируется с помощью
изображений, полученных электронным микроскопом высокого разрешения (HREM). Два
примера приведены на рис. 6.
Итак, впервые синтезирован фуллереноидный оксид, построенный из огромных Al84–сфер.
Большая схожесть этой структуры со структурой D2d -изомера фуллеренов C84
открывает дорогу к изучению других возможных соединений из этой серии,
отличающихся размером Aln–сфер, способом их соединения вследствие
другой природы и относительного количества щелочноземельных катионов, а также
благодаря возможности введения других элементов вместо алюминия, таких как Si,
Ge, Fe и т.д., и других катионов или анионов внутри Aln–сферы.
Как следствие, эти материалы могут обладать различными свойствами и применяться
для решения задач фотолюминесценции или термолюминесценции, магнетизма,
нелинейной оптики и даже катализа.
Литература
1. Ohta, M.,Maruyama, M.,Hayakawa, T. & Nishijo, T. Role of dopant on long-lasting phospor of
strontium aluminate. J. Ceram. Soc. Jpn 108, 284-289 (2000).
2. Mandelcorn, L. (ed.) Non-Stoichiometric Compounds (Academic, New York, 1964).
3. Helfferich, F. Ion Exchange Properties (McGraw-Hill, NewYork, 1962).
4. Wilson, S. T., Lok, B. M.,Masina, C. A., Cannan, T. R. & Flanigen, E. H.Aluminophosphate molecular
sieves: a new class of microporous crystalline inorganic solids. J. Amer. Chem. Soc. 104, 1146-1147
(1982).
5. Guth, J. L.,Kessler, H. & Wey, R. Stud. Surf. Sci. Catal. 28, 121 (1986).
6. Cheetham, A. K., Ferey, G. & Loiseau, T. Open-framework in inorganic materials.
Angew. Chem. Intl Edn 38, 3268-3282 (1999).
7. Rabo, J. A. & Schoonover, M. W. Early discoveries in zeolite chemistry and catalysis at Union Carbide
and follow up in industrial catalysis. Appl. Catal. A 222, 261-275 (2001).
8. Zones, S. I. & Davis, M. E. Zeolite materials: recent discoveries and future prospects.
Curr. Opin. Solid State Mater. Sci. 1, 107-117 (1996).
9. OKeefe, M., Eddaoudi, L. H.,Reineke, T. & Yaghi,O. M. Frameworks for extended solids: geometrical
design principles. J. Solid State Chem. 152, 3-20 (2000).
10. Ferey, G. Building units design and scale chemistry.
J. Solid State Chem. 152, 37-48 (2000).
11.Wells, A. F. Structural Inorganic Chemistry 5th edn (Oxford Univ. Press, Oxford, 1993).
12. Smith, J. V. Topochemistry of zeolites and related materials 1. Topology and geometry.
Chem. Rev. 88, 149-182 (1988).
13. Kraetschner,W., Lamb, L. D., Fostiropoulos, K. & Huffman,D. R. Solid C60: a new form of carbon.
Nature 347, 354-358 (1990).
14. Okada, S. & Saito, S. Number of extractable fullerene isomers and speciality of C84. Chem. Phys. Lett.
252, 94-100 (1996).
15. Bakakin,V. V. et al. The structure of frame strontium aluminate Sr6(Al12O24)Bi2O3 with inclusion of
Bi2O3 molecule. Zh. Strukt. Khim. 35, 92-99 (1994).
Сокращенный перевод с английского Т.Зиминой
|

















