История химии
Химия в двух измерениях
Нобелевская премия по химии 2007 года
В.Еремин
Химический факультет МГУ

Герхард Эртль
(род. 1936)
|
Химические
реакции бывают двух типов – гомогенные, то есть протекающие в объеме однородной
системы, и гетерогенные – те, которые происходят на поверхности раздела между
веществами. К гетерогенным относятся очень многие промышленные реакции, в которых
газообразные вещества реагируют между собой в присутствии твердых катализаторов,
например синтез SO3
или NH3. Окисление
выхлопных газов в автомобильных конвертерах также идет с участием твердых
катализаторов. Интересно, что именно благодаря гетерогенным процессам в
космическом пространстве образуются органические молекулы – это происходит на
поверхности частиц космической пыли.
Гетерогенные
реакции можно назвать двумерными, так как поверхность имеет всего два
пространственных измерения. Казалось бы, два измерения изучать проще, чем три,
однако при внимательном рассмотрении оказывается, что поверхностные реакции
могут быть очень сложными – ведь поверхность, в отличие от раствора, не всегда
бывает однородной и способ ее приготовления может оказывать существенное
влияние на ход протекания реакции.
Во
второй половине 20-го века были созданы физические методы анализа состава и
структуры поверхности твердых веществ, основанные на использовании лазерного
излучения и рассеяния частиц поверхностью. Сочетание новой структурной информации
с данными о скоростях реакций привело к настоящему прорыву в исследовании
механизмов гетерогенных реакций. В 2007 году "за исследования химических
процессов на твердых поверхностях" Герхард Эртль, профессор института Фрица Габера,
был удостоен Нобелевской премии по химии. Рассмотрим кратко его вклад в
развитие химии гетерогенных реакций.
Реакции на поверхности – конкуренция
физических и химических процессов
Гетерогенные
реакции, в отличие от гомогенных, никогда не бывают элементарными: они
обязательно включают несколько стадий – как химических, так и физических. Общий
ход процесса выглядит следующим образом: 1) газы подходят к поверхности, 2)
адсорбируются на ней, 3) связи между атомами в молекулах ослабляются или
разрываются, и реакция между реагентами легче происходит на поверхности, чем в
объеме; 4) затем продукты реакции удаляются с поверхности катализатора (происходит
десорбция), которая тем самым освобождается для приема новых молекул реагентов;
5) продукты от поверхности уходят в объемную фазу.
Первая
и последняя стадии имеют чисто физическую природу, третья – чисто химическую, а
адсорбция и десорбция могут представлять собой как физический, так и химический
процесс.
Рассмотрим
в качестве примера гидрирование этилена
C2H4
+ H2®
C2H6,
которое происходит в присутствии
катализатора – оксида цинка. Молекула водорода подлетает к поверхности оксида
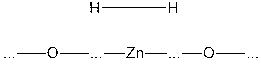
и образует с ней химические
связи, при этом связь между атомами водорода сначала ослабляется, а затем
разрывается:
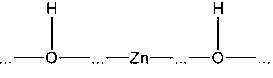
Таким образом, адсорбция здесь
имеет химическую природу. Затем к поверхности, покрытой атомами водорода,
подходит молекула этилена:
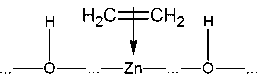
Встраиваясь на поверхности между
этими атомами, молекула C2H4 сначала присоединяет один из
двух соседних:
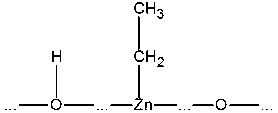 ,
,
а затем другой. Образовавшаяся
молекула C2H6 улетает от поверхности в газовую фазу:
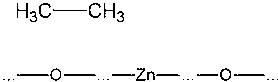
Из
этого примера видно, что для успешного протекания реакции поверхность должна
обладать определенными свойствами – структурными и энергетическими. Расстояние
между атомами на поверхности должно соответствовать размерам реагирующих
молекул, и атомы на поверхности должны быть способны сначала образовать
химические связи с реагентами, а потом – разорвать химические связи с
продуктами. Принцип структурного и энергетического соответствия – основной в
подборе катализаторов для промышленных реакций.
Охарактеризовать
механизм гетерогенной реакции – это значит выявить все элементарные стадии
процесса и определить их скорость и энергию активации. Это позволяет найти
способы управления скоростью процесса и полнотой его протекания. Такая
глобальная задача была решена Г.Эртлем для многих гетерогенных реакций, из
которых мы ограничимся только двумя – одной очень важной и одной очень интересной.
Удобрения – из воздуха: реакция синтеза
аммиака
Одна
из самых многотоннажных реакций в химической промышленности – синтез аммиака из
простых веществ:
N2 + 3H2 = 2NH3
Технологические основы этого
процесса были разработаны давно: уже в первой четверти 20 века. Во многом это
было сделано под давлением военной промышленности: из аммиака получают азотную
кислоту, которая используется для производства взрывчатых веществ. В настоящее
время эта реакция лежит в основе производства азотных удобрений.
Для
смещения равновесия в сторону продукта реакцию проводят при высоких давлениях
(сотни атмосфер), а для ускорения достижения равновесия добавляют катализатор –
металлическое железо с добавками гидроксида калия. Реакция происходит на
поверхности катализатора.
До
Эртля было известно, что реакция начинается с адсорбции азота и водорода поверхностью
катализатора. Кинетические исследования показали, что скорость всего процесса
лимитируется адсорбцией азота. Однако детальный механизм с помощью одних кинетических
методов установить не удавалось: было неизвестно, успевает ли азот
диссоциировать на атомы или нет. Необходима была дополнительная структурная
информация.
Эртль
начал исследования этой реакции в середине 1970-х годов с модельной системы –
чистого железа в высоком вакууме, то есть при очень низких давлениях азота и
водорода. В таких условиях возможно детальное изучение состава и структуры
поверхности с помощью физических методов, например дифракции электронов низкой
энергии или фотоэлектронной спектроскопии. Используя последний метод, Эртль
доказал, что на поверхности чистого железа при низких давлениях образуется
атомарный азот, N.
Последующие за этим исследования подтвердили, что по такому же пути реакция
идет и в промышленных условиях: при высоких давлениях на поверхности
коммерческих катализаторов. Таким образом, механизм синтеза аммиака из простых
веществ имеет вид:
H2(г) +
поверхность ↔ 2H(адс),
N2(г) +
поверхность ↔ 2N(адс),
N(адс) + H(адс) ↔ NH(адс),
NH(адс) + H(адс) ↔ NH2(адс),
NH2(адс) + H(адс) ↔ NH3(адс),
NH3(адс) ↔ NH3(г).
Лимитирующей стадией процесса
является вторая: она протекает с наименьшей скоростью.
Этот
механизм наряду с несколькими другими был предложен еще до работ Эртля, однако последнему
удалось не только установить истинный механизм, но и определить его
энергетические характеристики, то есть построить энергетическую диаграмму всего
процесса [1] (рис. 1).
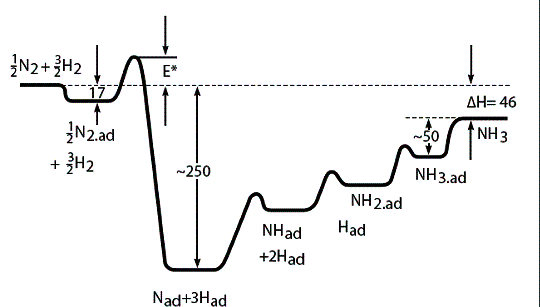
Рис. 1. Энергетическая диаграмма
синтеза аммиака из простых веществ на поверхности катализатора. Энергии даны в
кДж/моль.
Эртль
решил еще одну задачу, связанную с промышленными условиями синтеза аммиака. Он
объяснил, почему каталитическая реакция ускоряется, если к катализатору добавляют
калий. Оказалось, что калий непосредственно влияет на лимитирующую стадию – в
его присутствии азот легче адсорбируется на поверхности.
Анализируя
результаты этих исследований, в заслугу Эртлю можно поставить решение двух
принципиальных задач – научной и практической. Во-первых, исследуя модельные
системы, он установил детальный механизм реакции синтеза аммиака, а, во-вторых,
что не менее важно, доказал, что основные черты модельных систем сохраняются и
промышленных условиях. Иными словами, в своей области он установил связь науки
с промышленностью.
Химические колебания на поверхностных
волнах
Другая
практически важная реакция, которую исследовал Эртль, – каталитическое
окисление угарного газа (монооксида углерода) кислородом. Эта реакция происходит
на твердофазных катализаторах, входящих в состав конвертеров выхлопных газов в
автомобилях. Автомобильные катализаторы – это сложные смеси, содержащие оксид
алюминия Al2O3, оксид церия CeO2 и платиновые
металлы.
Для
изучения механизма окисления COкислородом Эртль исследовал модельную систему: он
рассматривал реакцию, происходящую на поверхности монокристаллов сверхчистой
платины. Применяя те же методы, что и для реакции водорода с азотом, Эртль установил
основные стадии окисления.
Сначала
реагенты из газовой фазы адсорбируются на поверхность, причем адсорбция COобратима,
а кислорода – необратима, причем молекула диссоциирует на атомы:
CO(г)
+ поверхность ↔ CO(адс),
O2(г)
+ поверхность ®
2O(адс).
Затем на поверхности атомы
кислорода присоединяются к молекулам CO:
CO(адс) + O(адс) ® CO2(адс).
И, наконец, продукт реакции –
углекислый газ – десорбируется с поверхности в объем:
CO2(адс)
®
CO2(г)
Суммарное уравнение реакции имеет
вид:
CO(г)
+ ½O2(г) ® CO2(г).
А дальше началось самое
интересное. Оказалось, что несмотря на кажущуюся простоту, данная реакция может
проявлять очень сложное поведение и зависит это, в первую очередь, от свойств
поверхности. Так, при низких давлениях газов и постоянной температуре на поверхности
кристаллов Pt(100) скорость окисления
периодически изменяется со временем. Это эффект был открыт Эртлем в 1982 году [2]
и стал первым в истории примером колебательной реакции на твердой поверхности.
При
изучении свойств поверхности, на которой адсорбированы молекулы, обнаружился
удивительный факт: в процессе реакции структура поверхности все время меняется,
причем также в колебательном режиме. Атомы на поверхности платины могут быть
расположены двумя способами – их называют поверхностными фазами [3]. В одной
фазе (гексагональной) у каждого атома шесть соседей, в другой – четыре (эту фазу
называют 1x1) (рис. 2). Чистая поверхность
платины, на которой нет адсорбированных молекул, имеет гексагональную
структуру. Она хорошо поглощает молекулы COи плохо – атомы O, поэтому сначала реакция
окисления на поверхности идет медленно. Когда степень заполнения поверхности
молекулами COпревышает некоторое критическое
значение, происходит "реконструкция" поверхности и она приобретает структуру 1x1, которая, напротив, хорошо поглощает атомы O. Число атомов Oна поверхности
растет, скорость реакции увеличивается, адсорбированные газы – COи O– реагируют между собой, продукт
– CO2 улетучивается в газовую фазу, и
поверхность платины очищается. Когда степень заполнения молекулами COуменьшается до какого-то предела, происходит обратная реконструкция – из 1x1 в гексагональную фазу, на которой нет кислорода и
реакция идет медленно. Таким образом, в процессе окисления колебания испытывает
не только скорость реакции, но и структура самой поверхности.
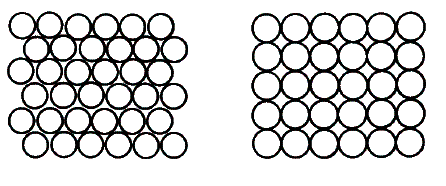
а) б)
Рис. 2. Структура поверхности Pt(100): а) гексагональная фаза; б) фаза 1х1.
Увидеть
эти колебания можно с помощью фотоэмиссионной электронной микроскопии (PEEM) [4]. Последний метод основан на том, что под действием
ультрафиолетового излучения с поверхности отрываются электроны, которые с
помощью системы электростатических линз направляются на флуоресцирующий экран.
Интенсивность флуоресценции определяется свойствами электронов, а последние зависят
от того, какая частица находится на поверхности. Участки, богатые оксидом
углерода, дают на экране более светлое изображение, а кислородом – более
темное.
Изображения,
полученные в процессе окисления CO, показали, что колебания структуры поверхности происходят не только
во времени, но и в пространстве [4]. В каждый момент времени на поверхности
есть участки, обогащенные CO, и участки с повышенным содержанием
O. В зависимости от условий (давления
газов и температуры) положение этих участков изменяется: на поверхности могут
двигаться спиральные волны (рис. 3), образоваться стоячие волны (рис. 4), а
возможен даже переход к хаотическому режиму со случайным расположением
поверхностных фаз [4].
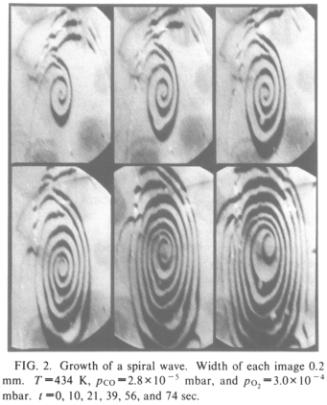
Рис. 3. Движение спиральных волн
на поверхности Pt. Условия: T = 434 K, pCO =
2.8×10–5 мбар, pO2 = 3.0×10–4 мбар. t = 0, 10, 21, 39, 56, 74 с. [4]

Рис. 4. Стоячие волны на
поверхности Pt, сопровождающиеся временными
колебаниями с периодом 2.8 с. Условия: T = 544 K, pCO = 1.2×10–4 мбар, pO2 = 3.1×10–4 мбар. t = 0, 0.6, 0.8, 1.4, 2.0, 2.2 с.
[4]
Все
эти экспериментальные наблюдения были подтверждены теоретически. Эртль с
коллегами предложил несколько моделей, которые позволили объяснить, откуда
берутся временные и пространственные колебания. Во всех случаях механизм содержал
автокаталитическую стадию, а кинетические уравнения были нелинейными, что, как
известно, является необходимым условием для самоорганизации. Замечательно, что
некоторые из уравнений допускали не только численное, но и аналитическое
решение: с их помощью можно было понять, как происходит переход от самоорганизации
к хаосу при варьировании условий реакции [5]. Описание сложных процессов с
помощью простых, но характеризующих самую суть моделей, это, по признанию коллег,
– важная черта научного стиля Эртля. "Он уверен, что природа устроена просто",
– говорят они.
За
прошедшие с тех пор два десятилетия исследования в области колебательных реакций
на твердой поверхности ушли далеко вперед. Было обнаружено еще несколько подобных
реакций и подробно изучены условия, в которых появляется колебательный режим. Математические
модели стали более изощренными, они описывают не только химические реакции, но
и диффузию по поверхности. Однако самые первые, пионерские экспериментальные и
теоретические исследования, заложившие основу этого раздела химии, были проведены
под руководством Г.Эртля.
От исследований механизмов – к управлению
скоростью реакции
Разумеется,
реальные промышленные процессы далеки от тех идеальных условий, в которых
проводил реакции Эртль. Платина в автомобильных катализаторах содержит многочисленные
примеси, а давление выхлопных газов – во много раз больше, чем в экспериментах
Эртля. В реальных условиях колебательный режим также возможен, хотя его причины
могут быть совсем другими. Заслуга Эртля состоит в том, что его результаты
позволили по-новому взглянуть на проблему управления химическими реакциями в
промышленности.
Обычно
химические процессы организуют так, чтобы они протекали в стационарном режиме
при некоторых условиях, оптимальных с точки зрения экономики, экологии и безопасности.
Устойчивость режима, как правило, поддерживается с помощью какого-либо процесса,
реализующего обратную связь. Однако, после открытия колебательных реакций в открытых
системах появилась идея организовывать промышленные реакции в нестационарном,
колебательном режиме. Работы Эртля позволили понять, какие факторы определяют
скорость колебательных реакций на поверхности. Ключевая идея состоит в
направленном изменении свойств поверхности катализатора не только во времени,
но и в пространстве. Например, технически возможно поддерживать
колебательный режим путем точечного нагревания отдельных участков поверхности с
помощью движущегося лазерного луча. Пока еще подобные подходы ограничены рамками
научных лабораторий, однако в любом случае арсенал принципиальных способов
управления химическими реакциями обогатился еще одним подходом, автором
которого стал лауреат Нобелевской премии по химии 2007 года, профессор Герхард
Эртль.
Литература
[1] G. Ertl. Primary steps in catalytic
synthesis of ammonia. J. Vac. Sci. Technol., 1983, v. A1, p. 1247-1253.
[2] G.Ertl, P.R.Norton, J.Rustig. Kinetic
oscillations in the platinum catalyzed oxidation of CO. Phys. Rev. Lett., 1982,
v. 49, p. 177-180.
[3] R.Imbihl, M.P.Cox, G.Ertl, H.Muller, W.
Brenig. Kinetic oscillations in the catalytic CO oxidation on Pt(100): theory.
J. Chem. Phys., 1985, v. 83, № 4, p. 1578-1587.
[4] S.Jakubith, H.H.Rotermund, W.Engel, A.von
Oertzen, G.Ertl. Spatiotemporal concentration patterns in a surface reaction:
propagating and standing waves, rotating spirals, and turbulence. Phys. Rev.
Lett., 1990, v. 65, № 24,
p. 3013-3016.
[5] M.Eiswirth, K.Krischer, G. Ertl. Transition
to chaos in an oscillating surface reaction. Surf. Sci., 1988, v. 202, № 3, p.
565-591.
Дополнительная литература
1) Информация Нобелевского
комитета о научных заслугах Эртля: http://nobelprize.org/nobel_prizes/chemistry/laureates/2007/chemadv07.pdf
2) Об адсорбции и кинетике
гетерогенных реакций можно прочитать в учебниках по физической химии:
а) В.В.Еремин, С.И.Каргов,
И.А.Успенская, Н.Е.Кузьменко, В.В.Лунин. Основы физической химии. – М.:
Экзамен, 2005. § 10, 23.
б) Б.В.Романовский. Основы
химической кинетики. – М.: Экзамен, 2006. Гл. 9.
в) Практическая химическая
кинетика / Под ред. М.Я.Мельникова. – М.: Изд-во Моск. ун-та, 2006. Гл. 9.
г) Г.М.Панченков, В.П.Лебедев.
Химическая кинетика и катализ.
Простые
задачи по кинетике гетерогенных реакций можно найти в книге: В.В.Еремин.
Теоретическая и математическая химия для школьников. – М.: МЦНМО, 2007.
3) Колебательным реакциям
посвящен научный сборник:
Колебания и бегущие волны в
химических системах. – М.: Мир, 1988.
Краткое
описание теории устойчивости нелинейных систем, а также задачи по колебательным
реакциям – в учебнике: В.В.Еремин, С.И.Каргов, И.А.Успенская, Н.Е.Кузьменко,
В.В.Лунин. Основы физической химии. – М.: Экзамен, 2005. § 28.



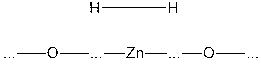
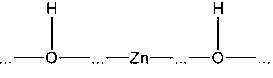
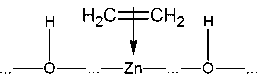
 ,
,