В учебнике особое внимание уделено вопросам термодинамики и кинетики химических реакций и строения вещества. В этом курсе химии впервые представлены вопросы новой области химических знаний, крайне важной для специалистов естественных наук, - открытые и неравновесные системы (образование упорядоченных структур при неравновесном состоянии системы, химическая и биологическая эволюция, флуктуации и бифуркации и т.п.). Химия элементов рассматривается во всех темах учебника.
В данном учебнике не повторяется школьный курс химии. Предполагается, что студенты, изучающие данный учебник, обладают основами знаний по химии в части названий классов веществ (оксиды, основания, кислоты, гидроксиды, соли), составления уравнений реакций и подбора стехиоме-трических коэффициентов.
К данному учебнику прилагается "Лабораторный практикум и сборник задач".
Учебник соответствует Федеральному государственному образовательному стандарту высшего образования четвертого поколения.
Для бакалавров, магистрантов и специалистов, обучающихся по естественно-научным направлениям и специальностям, а также может быть полезен учащимся старших классов.
Оглавление
| Введение | |
7 |
| Глава 1. Реакция и вещество |
| 11 |
| 1.1. Материя, вещество, поле |
| 11 |
| 1.2. Атомное ядро и изотопы |
| 18 |
| 1.3. Устойчивость и распространенность ядер атомов |
| 19 |
| 1.4. Ядерные реакции |
| 20 |
| 1.5. Радиоактивность атмосферы |
| 22 |
| 1.6. Радиоактивность гидросферы и литосферы |
| 25 |
| 1.7. Изотопный обмен |
| 30 |
| 1.8. Разделение изотопов |
| 31 |
| 1.9. Определение ядерных излучений |
| 33 |
| 1.10. Возраст природных объектов |
| 34 |
| 1.11. Фазовые состояния веществ |
| 36 |
| 1.12. Газовое состояние вещества |
| 38 |
| 1.13. Моль и мольная масса |
| 45 |
| 1.14. Валентность |
| 47 |
| 1.15. Соединения переменного состава |
| 48 |
| 1.16. Электронное строение атома |
| 51 |
| 1.17. Квантовые числа |
| 54 |
| 1.18. Многое лрктпонныр атомы |
| 59 |
| 1.19. Периодичность свойств атомов элементов |
| 61 |
| 1.20. Энергетические уровни атомов |
| 63 |
| 1.21. Молекулы |
| 66 |
| 1.22. Химическая связь |
| 68 |
| 1.22.1. Метод (теория) валентных связей |
| 71 |
| 1.22.2. Гибридизация электронных орбиталей |
| 72 |
| 1.22.3. Одинарная, двойная и тройная связи, σ- и π-связь |
| 76 |
| 1.22.4. Метод (теория) молекульных орбиталей |
| 78 |
| 1.22.5. Донорно-акцепторный метод образования связи |
| 83 |
| 1.22.6. Водородная связь |
| 85 |
| 1.22.7. Металлическая связь |
| 88 |
| 1.22.8. Обзор типов химической связи |
| 90 |
| Контрольные вопросы |
| 90 |
| Глава 2. Термодинамика химических реакций |
| 94 |
| 2.1. Системы |
| 94 |
| 2.2. Тепловой эффект реакции |
| 97 |
| 2.3. Изменение энтальпии |
| 101 |
| 2.4. Закон Гесса |
| 104 |
| 2.5. Энтропия и ее изменение |
| 106 |
| 2.6. Изобарный потенциал реакции |
| 114 |
| 2.7. Константа равновесия |
| 117 |
| 2.8. Диаграмма состояния воды |
| 121 |
| 2.9. Правило фаз Гиббса |
| 125 |
| 2.10. Кривая нагревания воды |
| 126 |
| 2.11. Открытые системы |
| 128 |
| 2.11.1. Стационарное состояние |
| 130 |
| 2.11.2. Диссипативные структуры |
| 132 |
| 2.11.3. Флуктуации |
| 133 |
| 2.11.4. Бифуркации |
| 134 |
| 2.11.5. Нелинейные процессы |
| 136 |
| 2.11.6. Непредсказуемость |
| 137 |
| 2.11.7. Ячейки Бенара |
| 139 |
| 2.11.8. Образование муравейника, города и химического соединения |
| 141 |
| 2.12. Уровни организации вещества и эволюция Вселенной |
| 142 |
| 2.13. Время и эволюция |
| 143 |
| Контрольные вопросы |
| 146 |
| Глава 3. Кинетика химических реакций |
| 149 |
| 3.1. Скорость реакции |
| 149 |
| 3.2. Зависимость скорости реакции от концентрации |
| 150 |
| 3.3. Кинетическое уравнение и порядок реакции |
| 152 |
| 3.4. Молекульность реакции |
| 155 |
| 3.5. Реакции первого порядка |
| 157 |
| 3.6. Начальные представления о механизме реакции |
| 161 |
| 3.7. Катализ |
| 165 |
| 3.8. Периодические процессы |
| 169 |
| 3.9. Циклические процессы и круговороты веществ |
| 177 |
| 3.10. Цепные реакции |
| 180 |
| 3.11. Константа равновесия |
| 185 |
| 3.12. Зависимость скорости реакции от температуры |
| 189 |
| 3.13. Неравновесная кинетика |
| 194 |
| 3.14. Переход из метастабильного состояния. |
| 195 |
| 3.15. Реакции при низких температурах |
| 196 |
| 3.16. Другие факторы, влияющие на скорость реакции |
| 197 |
| 3.17. Основное уравнение химической кинетики |
| 198 |
| Контрольные вопросы |
| 201 |
| Глава 4. Вода и растворы |
| 204 |
| 4.1. Аномальные свойства водын |
| 204 |
| 4.2. Ионное произведение воды |
| 208 |
| 4.3. Процессы, происходящие при диссоциации воды |
| 210 |
| 4.4. Тяжелая вода |
| 213 |
| 4.5. Растворы |
| 215 |
| 4.6. Концентрация |
| 218 |
| 4.7. Растворимость |
| 220 |
| 4.8. Природные воды |
| 224 |
| 4.9. Очистка воды |
| 226 |
| 4.10. Давление насыщенного пара |
| 227 |
| 4.11. Отклонения от закона Рауля |
| 232 |
| 4.12. Эбулиоскопия и криоскопия |
| 234 |
| 4.13. Осмотическое давление |
| 236 |
| 4.14. Электролиты и неэлектролиты |
| 240 |
| 4.14.1. Сильные электролиты. |
| 241 |
| 4.14.2. Слабые электролиты |
| 243 |
| 4.14.3. Теория растворов сильных электролитов |
| 245 |
| 4.15. Произведение растворимости |
| 249 |
| 4.16. Влияние некоторых факторов на растворимость |
| 252 |
| Контрольные вопросы |
| 255 |
| Глава 5. Среда растворов |
| 257 |
| 5.1. Кислоты и основания |
| 257 |
| 5 2 Индикаторы |
| 259 |
| 5.3. Среда растворов кислот и оснований |
| 260 |
| 5.4. Среде растворов солей. Гидролиз иона |
| 265 |
| 5.5. Буферные растворы |
| 273 |
| 5.6. Реакции амфотерного перехода |
| 276 |
| 5.7. Влияние среды раствора на состав иона |
| 279 |
| Контрольные вопросы |
| 282 |
| Глава 6. Окислительно-восстановительные реакции |
| 283 |
| 6.1. Реакции окисления-восстановления и их уравнения |
| 283 |
| 6.2. Окислители и восстановители |
| 286 |
| 6.3. Соединения хлора и хлорирование воды |
| 292 |
| 6.4. Группы окислительно-восстановительных реакций |
| 297 |
| 6.5. Электродные потенциалы |
| 299 |
| 6.6. Электродвижущая сила реакции |
| 302 |
| 6.7. Константа равновесия |
| 303 |
| 6.8. Формула Нернста |
| 305 |
| 6.9. Механизм окислительно-восстановительной реакции |
| 306 |
| 6.10. Реакции на границе металл - раствор |
| 308 |
| 6.11. Диаграммы Е - рН |
| 314 |
| 6.12. Концентрационные элементы |
| 317 |
| 6.13. Электрохимическая коррозия |
| 320 |
| 6.14. Электролиз и аккумуляторы. |
| 323 |
| Контрольные вопросы |
| 331 |
| Глава 7. Реакции с участием комплексных соединений |
| 333 |
| 7.1. Комплексные соединения и их получение |
| 333 |
| 7.2. Строение и свойства комплексных соединений |
| 336 |
| 7.3. Свойства комплексных соединений |
| 337 |
| 7.4. Названия комплексных соединений |
| 339 |
| 7.5. Константы нестойкости и устойчивости |
| 344 |
| 7 6 Двойные соли |
| 347 |
| 7.7. Растворы комплексных соединений |
| 348 |
| 7.8. Образование комплексных соединений |
| 349 |
| 7.9. Строение комплексного иона |
| 354 |
| 7.10. Гидраты |
| 355 |
| 7.11. Изомерия комплексных соединений |
| 356 |
| 7.12. Реакции с участием комплексных соединений |
| 364 |
| 7.13. Некоторые другие случаи комплексообразования |
| 374 |
| Контрольные вопросы |
| 378 |
| Глава 8. Дисперсное состояние вещества |
| 380 |
| 8.1. Дисперсные системы |
| 380 |
| 8.2. Поверхностная энергия |
| 381 |
| 8.3. Классификация дисперсных систем |
| 383 |
| 8.4. Лиофильные и лиофобные системы |
| 384 |
| 8.5. Суспензии |
| 386 |
| 8.6. Золи |
| 389 |
| 8.7. Гранула и мицелла |
| 391 |
| 8.8. Термодинамический и электрокинетический потенциалы |
| 394 |
| 8.9. Знак заряда гранулы |
| 396 |
| 8.10. Электрокинетические явления |
| 397 |
| 8.11. Устойчивость дисперсных систем |
| 400 |
| 8.12. Коагуляция |
| 401 |
| 8.13. Пептизация |
| 405 |
| 8.14. Диализ |
| 406 |
| 8.15. Гели |
| 408 |
| 8.16. Эмульсии |
| 412 |
| 8.17. Пены |
| 415 |
| 8.18. Почва |
| 418 |
| 8.19. Аэрозоли |
| 418 |
| 8.20. Дым, туманы и облака |
| 421 |
| 8.21. Поверхностные явления |
| 423 |
| 8.22. Расклинивающее давление |
| 425 |
| Контрольные вопросы |
| 425 |
| Глава 9. Кристаллы |
| 428 |
| 9.1. Строение кристаллов |
| 428 |
| 9.2. Энергия кристаллической решетки |
| 431 |
| 9.3. Дефекты кристаллической структуры |
| 432 |
| 9.4. Анизотропия |
| 434 |
| 9.5. Полиморфизм |
| 437 |
| 9.6. Изоморфизм |
| 439 |
| 9.7. Твердые растворы |
| 440 |
| 9.8. Магнитные свойства кристаллов |
| 442 |
| 9.9. Люминесценция |
| 452 |
| 9.10. Образование кристаллов |
| 453 |
| 9 11 Гидраты газов |
| 465 |
| 9.12. Жидкие кристаллы |
| 465 |
| Контрольные вопросы |
| 467 |
| Заключение |
| 469 |
| Литература |
| 470 |
Введение
Химия - наука о превращениях веществ. Химия прочно связана со всеми другими науками.
Все процессы, происходящие в окружающем нас мире и внутри нас, сопровождаются превращениями веществ.
Биологические и геологические процессы, жизнь в любых ее проявлениях (мышление и поведение человека,
действие лекарств, питание), климат и погода, производство любых материалов - все это обусловлено химической
природой мироздания.
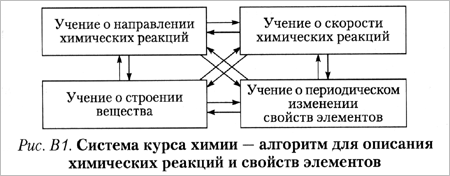
Предложено несколько классификаций химических знаний. Одна из них - по составляющим химию учениям. Химия состоит из трех главных учений: о направлении химических реакций {химическая термодинамика), о скорости химических реакций {химическая кинетика) и о строении вещества.
Для облегчения изучения огромного числа неорганических веществ вводится еще одно учение - о периодическом изменении свойств элементов (рис. В1).
Эти учения теснейшим образом связаны между собой, поэтому, изучая материал одного учения, мы будем по возможности чаще и больше привлекать положения других учений.
Такой подход называется многосторонним рассмотрением изучаемого объекта. Постарайтесь и вы в будущем не только в химии, но во всех изучаемых вами науках пользоваться многосторонним рассмотрением, привлекая к решению какого-либо вопроса максимальное количество имеющихся у вас знаний.
Каждая наука имеет свои цели. Цель химии - получение нужных человеку веществ и энергии для поддержания температуры в помещении
и передвижения транспорта. К сожалению, большинство реакций сопровождается образованием ненужных и часто вредных веществ. Уменьшение их количества или поиск путей получения из них других полезных нам веществ -
одна из задач современной химии.
Данный учебник предназначен для студентов, обучающихся по естественно-научным направлениям и специальностям.
Им могут пользоваться также учащиеся старших классов.
В учебнике особое внимание уделено вопросам термодинамики и кинетики химических реакций. В этом курсе химии впервые представлены
вопросы новой области химических знаний, крайне важной для специалистов естественных наук, - открытые и неравновесные системы (образование упорядоченных структур при неравновесном состоянии системы,
химическая и биологическая эволюция, флуктуации и бифуркации и т.п.). Химия элементов рассматривается во всех темах учебника.
В данном учебнике не повторяется школьный курс химии. Предполагается, что студенты, изучающие данный учебник, обладают основными
знаниями по химии в рамках названий классов веществ (оксиды, основания, кислоты, гидроксиды, соли), составления уравнений реакций и
подбора стехиометрических коэффициентов.
В учебнике не используются некоторые понятия, которые можно встретить в других учебниках химии, - степень окисления, электроотрицательность,
экзотермические и эндотермические реакции, метод электронного баланса,
молекульное написание уравнений реакций электролитов в водных растворах. Валентность рассматривается стехиометрическая и спиновая.
Зависимость скорости химических реакций от концентрации дается не в степени стехиометрических коэффициентов. В учебнике нет подробного
изложения органической химии, но в качестве иллюстрации отдельных моментов используются примеры органических соединений.
При чтении учебника вы встретите много вопросов по излагаемому материалу, которые задаются, чтобы читатель мог недолго подумать
над ответом и тем самым развить свое творческое мышление. Все вопросы в главах пронумерованы.
В начале каждой главы учебника приводятся знания, которые приобретает студент в результате ее изучения.
Знания - это представление о чем-либо, необходимое для усвоения содержания курса химии: законы, правила, принципы, теоретические положения.
Знания и умения обязательно выражаются студентом устной и письменной речью. В знания включены теоретические представления курса и умения как составная часть знаний, заключающаяся в способности произвести расчет по уравнению, поставить химический эксперимент, составить таблицу данных, нарисовать график и т.п.
В результате изучения материалов данного учебника студенты должны:
знать
- основные законы химии;
- электронное строение атома;
- виды, свойства и механизмы образования химической связи;
- закономерности изменения свойств химических элементов по периодам и группам периодической системы;
- основы химической термодинамики и кинетики химических процессов;
- особенности строения и свойства дисперсных систем;
- особенности электрохимических процессов в растворах;
- особенности строения и свойства комплексных соединений;
- особенности строения и свойства кристаллов;
уметь
- составлять химические формулы веществ, уравнения химических реакций и производить расчеты по ним;
- характеризовать свойства веществ в газообразном, жидком и твердом состоянии;
- пользоваться периодической таблицей химических элементов при расчетах;
- составлять электронные и графические формулы атомов и определять значения квантовых чисел электронов атома элемента;
- определять тепловой эффект процессов, возможность протекания химических реакций;
- рассчитывать константу равновесия для обратимых процессов;
- решать задачи на способы выражения состава растворов;
- определять направленность реакций в растворах электролитов;
- определять строение коллоидной частицы и объяснять механизм возникновения и строение двойного электрического слоя на поверхности коллоидных частиц;
- расставлять коэффициенты в оксилительно-восстановитель-ных реакциях;
- вычислять электродный потенциал металла в растворе соли разной концентрации, рассчитывать ЭДС гальванического элемента;
- определять заряды комплексообразователя, лигандов и комплексного иона, координационное число комплексообразователя;
владеть
- теоретическими основами химической науки;
- способами проведения расчетов по химическим формулам и уравнениям химических реакций с применением знаний основных законов химии;
- основными представлениями о периодических и непериодических зависимостях свойств химических элементов и их соединений;
- методами анализа химической связи;
- способами решения задач по химической термодинамике и химической кинетике;
- представлениями о природе и свойствах молекулярных и ионных растворов;
- способами составления уравнений гидролиза солей;
- представлениями о процессах окисления и восстановления;
- методами расстановки коэффициентов в уравнении реакции;
- навыками составления структурных формул изомеров предложенного вещества.
Данный учебник следует изучать совместно с книгой практикума, который соответствует главам данного учебника и содержит практические задания и описание лабораторных работ. Также в практикуме приведены основные термодинамические характеристики многих веществ, константы и другие параметры, требующиеся для решения задач по химии.
Автор сердечно благодарен своей жене Ольге Мартыновне, создавшей исключительно благоприятную домашнюю обстановку для работы над этим учебником, и своим сыновьям Илюше и Косте, помогавшим в этой работе.
Автор будет рад получить замечания и пожелания по адресу: 119992, Москва, МГУ, химический факультет, кафедра общей химии, лаборатория научных основ обучения химии.
|


