Научные достижения химического факультета
Химики МГУ объяснили природу сверхбыстрой реакции в зрительных фоторецепторах
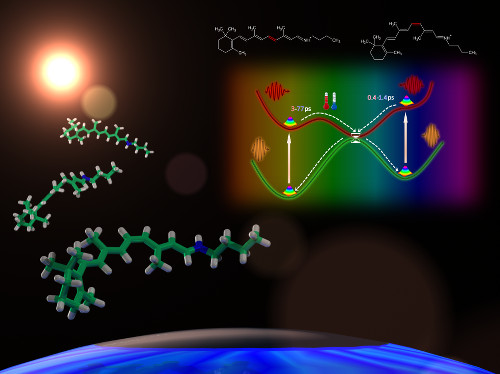
Фотоизомеризация ретиналя - первичный процесс при передаче зрительного сигнала
Сотрудники химического факультета МГУ совместно с коллегами
из Орхусского университета (Дания) установили механизм и определили скорость
инициируемой светом реакции для молекулы, отвечающей за возникновение
зрительного сигнала, – одного из самых быстрых биохимических превращений в
природе.
Процессы, происходящие в природе под действием света, такие как
фотосинтез у растений, зрение у позвоночных, сопровождаются химическими
превращениями хромофорных групп фотоактивных белков – небольших
молекул, отвечающих за поглощение кванта световой энергии. Ученые десятилетиями
изучают факторы, влияющие на высокую эффективность светозависимых биохимических
процессов в живых организмах. Фотохимические превращения в живых системах
происходят с невероятными скоростями – на временах порядка сотен фемтосекунд
(10-13 с). Основной частью светопоглощающих белков зрительной
рецепции является молекула ретиналя, система двойных связей которой отвечает за
поглощение света в видимом диапазоне.
Химическая "основа" зрения – изменение положения
заместителей у двойных связей ретиналя, так называемая цис-транс изомеризация.
Механизм изомеризации ретиналя у бактерий и у животных различаются: при
поглощении фотона цис-форма переходит в транс-изомер у животных, а у бактерий
наоборот – транс-изомер ретиналя переходит в цис-форму. Кроме того, у молекул
ретиналя "разных царств природы" изомеризуются разные двойные связи. Времена
этих превращений ранее определили как для одиночных молекул ретиналя в
растворе, так и в составе светочувствительных белков – зрительных
фоторецепторов. Оказалось, что во многих случаях скорость фотоизомеризации в
растворе падает в сотни раз. В связи с этим возник фундаментальный вопрос,
оказывает ли белковое окружение ускоряющее (каталитическое) воздействие на
реакцию, или оно просто защищает молекулу ретиналя от воздействия растворителя.
Российские и датские ученые впервые ответили на этот вопрос,
долгое время остававшийся без ответа. Для этого датскими учеными был разработан
новый экспериментальный метод для исследования заряженных биологических
хромофоров в газовой фазе с использованием фемтосекундной спектроскопии с
временным разрешением и современных ион-накопительных технологий. Подготовка к
таким экспериментам и их проведение занимает несколько лет. Сотрудники
лаборатории квантовой фотодинамики, созданной недавно на химическом факультете
МГУ по программе развития Московского университета, провели анализ результатов
и интерпретировали полученные данные с помощью квантовохимических расчетов
высокого уровня точности. Моделирование механизмов фотохимических реакций
требует огромной вычислительной мощности. Расчеты российские химики проводили
на суперкомпьютерном
комплексе "Ломоносов" Московского университета. Ученые
установили, что фотоизомеризация ретиналя в газовой фазе действительно может
быть очень быстрой - сотни фемтосекунд для цис-изомера, и медленной - несколько
пикосекунд (10-12 с) для полностью транс-изомера. Таким образом,
ученые выяснили, что первичная фотохимическая реакция в белках зрительной
рецепции проходит так же быстро, как и для изолированной молекулы ретиналя. Бактериальные
родопсины, напротив, значительно ускоряют реакцию и, более того, меняют
специфичность реакции изомеризации.
"Наши результаты показывают возможность принципиально нового
подхода в исследованиях фотохимических реакций в белках. Изучение эталонных
реакций, таких как превращения изолированных молекул, помогает сделать
заключение о том, как функционируют белки и какова роль белкового окружения", -
рассказала один соавторов, доцент, к.ф.-м.н. Анастасия Боченкова.
Работа ученых опубликована
в журнале Nature Communications. Исследование выполнено при
поддержке гранта Российского научного фонда.

